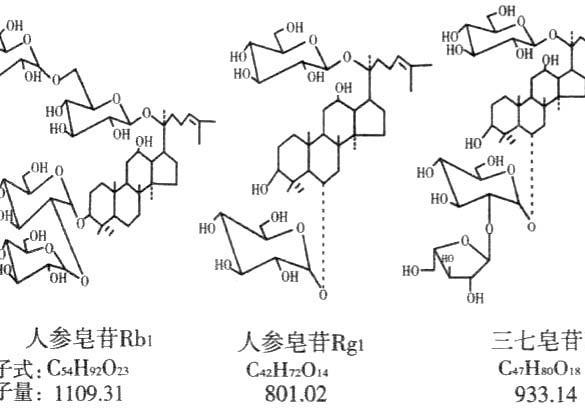
范文一:五环三萜皂苷生物合成与调控的研究进展_赵云生
中草药 Chinese Traditional and Herbal Drugs 第40卷第2期2009年2月
#327#
五环三萜皂苷生物合成与调控的研究进展
赵云生1, 2, 万德光1*, 陈 新1, 李占林2, 田洪岭2*
(11成都中医药大学药学院, 四川成都 610075; 21山西省农科院经济作物研究所, 山西汾阳 032200) 摘 要:五环三萜皂苷是一类重要的天然产物, 具有多种生理活性, 临床应用前景诱人, 但自然界中, 其产量较低。采用分子生物学与蛋白质组学相关知识, 通过代谢工程或基因工程进行五环三萜皂苷生物合成的工厂化生产, 具有广阔的市场前景。综述了五环三萜皂苷生物合成途径及其调控因子的研究进展, 并简要探讨了五环三萜皂苷生物合成的研究方法。
关键词:五环三萜皂苷; 生物合成; 调控中图分类号:R28211 文献标识码:A 文章编号:0253-2670(2009) 02-0327-04
Advances in studies on biosynthesis and regulation of pentacyclic triterpenoid saponin
ZH AO Yun -sheng 1, 2, WAN De -g uang 1, CH EN Xin 1, LI Zhan -lin 2, T IAN H ong -ling 2
(11Co llege of P harmacy, Chengdu U niversit y of T raditional Chinese M edicine, Cheng du 610075, China; 21Inst itute of Industr ial Cro p, Shanx i A cademy of A gr icultura l Sciences, F eny ang 032200, China)
Key words:pentacyclic tr iterpenoid saponin; biosynthesis; reg ulation
五环三萜皂苷是一类重要的天然化合物, 大多以游离或苷类的形式广泛存在于自然界。依据苷元的不同, 五环三萜皂苷可分为齐墩果烷(o leanane) 型、乌苏烷(ur sane) 型、羽扇豆烷(lupane) 型和木栓烷(friedeiane) 型等多种不同类型的化合物。大量的研究表明, 含五环三萜母核的皂苷化合物具有广泛的药理作用和重要的生物活性, 尤其在抗炎、护肝、抗肿瘤、抗H IV 以及机体免疫调节等方面已经显现出令人注目的活性, 显示了五环三萜皂苷广泛的应用前景[1]。
目前对五环三萜皂苷的生物合成途径已有一定的了解, 其生物合成途径一般分为4个阶段:(1) 活性异戊二烯单位v 3-异戊烯焦磷酸酯(I PP ) 和C , C -二甲基烯丙焦磷酸酯(DM A P P) 的生物合成; (2) 2, 3-氧化鲨烯的生物合成; (3) 五环三萜碳环系统的生物合成; (4) 环上复杂的官能化反应过程, 最终形成完整的五环三萜皂苷分子[2]。
在自然界中, 很多具有重要价值的五环三萜皂苷产量较低, 利用栽培措施大幅度地提高产量难度很大, 如果从分子水平上对其生物合成的关键基因进行调控, 促进表达, 不仅能够提高目标产物的量, 而且还可改变药用植物各种成分之间的比例, 减少甚至完全去除某些有毒成分, 这是单靠栽培措施难以实现的。随着对五环三萜皂苷生物合成途径及相关酶研究的不断深化, 通过代谢工程直接合成或利用基因工程实现五环三萜皂苷的工业化生产与田间种植, 将大大弥补产量的不足, 产生良好的社会及经济效益。
1 IPP 和DMAPP 的生物合成与调控
IP P 和DM A PP 是公认的萜类成分在生物体内合成的真正前体, 是生物体内的/活性异戊二烯0物质。动物细胞中IP P 的形成经由经典的甲羟戊酸(M VA ) 途径(图1) 。这一途径中不可逆的限速反应是3-羟基-3-甲基戊二酸单酰辅酶A (H M G -Co A) 经H M G -Co A 还原酶还原形成甲羟戊酸。在植物细胞中, IP P 合成类异戊二烯至少发生在3个不同部位:内质网(胞液) 、线粒体(和/或高尔基体) 及质体[3, 4]。现在发现的植物HM G -CoA 还原酶只定位于内质网的胞液面。L ichtenthaler 等[5]经过大量的实验认为:在大多数乃至全部的质体中, IPP 是以丙酮酸和甘油醛-3-磷酸作为前体, 先合成2-甲基赤藓醇-4-磷酸(M EP ) , 再经过磷酸化和环化等多个反应, 最终生成IP P, 称之为IPP 生物合成的M EP 途径(图1) , 并非以乙酰辅酶A 为前体由甲羟戊酸途径合成。
DM AP P 是IP P 的烯丙基异构体, 由IPP 异构酶(IPI) 催化形成, 和IP P 一起构成类异戊二烯的活性单位。这是一步可逆反应。IP P 异构酶活性的调节可能参与调控类异戊二烯的生物合成。有学者发现在大肠杆菌中经过M EP 途径可以直接产生IPP 和DM A PP, 而不需要IP P 异构酶[6~深入研究。
植物中通常含有多个HM G -CoA 还原酶基因, 在真核生物细胞, 特别是在植物细胞中HM G -CoA 还原酶基因具
8]
。
高等植物中类异戊烯合成是否需要IPP 异构酶, 需要进一步
*
收稿日期:2008-06-19
基金项目:山西省自然科学基金项目:远志道地性基因与蛋白质组遗传多样性研究(2007011091) ; 四川省教育厅科研基金项目:远志功
能基因与蛋白质研究(07ZC014) ; 成都中医药大学/优秀博士研究生科研创新基金0项目:远志鲨烯环氧酶cDNA 基因的克隆与表达(070104)
作者简介:赵云生(1974) ) , 男, 山西闻喜人, 博士, 助理研究员, 主要从事中药品种、质量和资源开发研究。
T el:(0358)3321076 13408670774 E -mail:zw hjzs @126. com
T el:87779801
#328#
中草药 Chinese Traditional and Herbal Drugs 第40卷第2期2009年2月
起限制作用[9~
11]
有高度的保守性, 它们共同编码H M G -CoA 还原酶的同工酶。甲羟戊酸是合成IP P 的前体, HM G -CoA 还原酶是否通过调控甲羟戊酸的合成而成为整个类异戊二烯生物合成途径的关键酶, 是利用基因工程生产有效成分最重要的问题。这方面虽然进行大量的研究, 却得到了两种不同的结论, 一是认为H M G -CoA 还原酶既然作为萜类物质的合成前体, 提高H M G -CoA 还原酶的活性应该可以提高类异戊二烯的量; 二是认为由于存在着无甲羟戊酸的IP P 生物合成途径, 或者由于萜类物质的生物合成步骤太复杂, 较早期的代谢中间产物对终产物的影响较弱, 该酶对萜类物质的合成速率不
。在不同植物中, 五环三萜皂苷合成是否
需要以H M G -Co A 还原酶作为关键酶调控代谢过程, 还有待进一步研究。
2 2, 3-氧化鲨烯的生物合成与调控
尽管存在着无甲羟戊酸的IPP 生物合成途径, 但许多具有重要生物活性的类异戊二烯物质的生物合成仍然依靠胞质的甲羟戊酸途径。依次在香叶二磷酸合成酶(G PS) 、法呢二磷酸合成酶(FP S) 、鲨烯合成酶(SS) 和鲨烯环氧酶(SE) 的催化下, 最终合成2, 3-氧化鲨烯[12](图1) 。此过程中SS 和SE
是最关键的两个酶。
图1 五环三萜皂苷生物合成途径
Fig. 1 Biosynthesis pathway of pentacyclic triterpenoid saponin
在环丙甲醇二磷酸中间体介导下, SS 催化2个法呢二磷酸(F PP) 分子以头对头的形式形成还原性的二聚体[13]。SS 催化两分子F PP 形成一分子鲨烯(SQ ) 要经两步反应。第一步反应是两分子的F PP 通过异戊烯基转移反应缩合成前鲨烯焦磷酸(P SQ P P) , 并释放出一分子无机二磷酸。在这个过程中, 其中一个FP P 的C1-C2的双键作为另一个F PP 的异戊烯基受体; 第二步反应是P SQP P 在N A DPH 作为氢为SQ P P 化为SQ 的过程中有一个正离子的环丙烷进行了重排。对于PSQ P P 合成早期的动力学, 曾用乒乓反应机制(Ping -Pong mechanism) 来解释, 而对从P SQP P 和NA DP H 合成为SQ 用依次反应机制(O rdered mechanism ) 来解释。最近的研究支持在PSQ P P 形成过程中, F PP 是依次叠加到两个不等价的F PP 结合位点上。A gnew 和Poljak 发现F PP 浓度在100L mol/L 以上时, F PP 会抑制SQ 的合成, 但并不抑制等[14]F PP
中草药 Chinese Traditional and Herbal Drugs 第40卷第2期2009年2月
SQ 的合成, 但不抑制PSQ PP 合成, 并指出由于F PP 与NA DP H 的竞争, 而产生底物选择性抑制作用, 当F PP 浓度高时, 第3个分子的F PP 结合于E #F PP #F PP 三元复合物上, 因而阻碍了E #F PP #F PP #N AD PH 复合物的形成, 但并没有干扰PSQ P P 形成反应, SS 催化反应的限速步骤是在SQ 和PSQ PP 形成之前。
SE 是一种细胞膜结合酶, 催化SQ 在C=C 之间插入一个氧原子形成2, 3-环氧角鲨烯, 是五环皂苷生物合成路径中的限速酶之一。酶反应除需要分子氧外还需要F AD 、N A D -P H(真菌SE 需N A DH ) 、上清液蛋白因子(SP F) 等, 其中SPF 可以用T rit onX -100代替[15]。Cho i 等[16]在研究人参皂苷合成时, 已识别3个编码SE 酶的转录物, 这表明在人参基因组中SE 酶形成了一个小的多基因家族。Suzuki 等[17]通过D NA 琼脂印迹分析, 在苜蓿基因组中发现了2个SE 基因(SE1和SE2) 。SE1和SE2编码的蛋白与人参中公认的SE 编码蛋白高度相似, 分别有7711%和7414%的序列完全相同。用茉莉酸甲酯(met hy l jasmonate, M eJA ) 处理苜蓿后, SE1转录物并没有被诱导, 相反, SE2转录物的诱导率却很高。这表明SE2并不是SE1, 它们在植物甾醇和三萜类皂苷合成过程中都起到重要的作用。3 五环三萜碳环系统的生物合成与调控
五环三萜碳环系统的生物合成主要通过氧化鲨烯环化酶(O SC) 的环化作用生成, 是由2, 3-氧化鲨烯在O SC 的催化下, 经过一系列的质子化作用、环化、重排和去质子化作用形成的。这一反应是三萜皂苷生物合成途径的一个分支反应, 因而O SC 是整个三萜皂苷生物合成的关键酶。该酶属于一个超家族, 大多编码OSC 的基因是由5个蛇麻脂醇合成酶基因和7个公认的五环三萜合成酶基因组成的。OSC 三萜合成酶家族各成员间表现高度的同源性, 都含有一些高度保守的序列, 一个是与底物结合有关的DDT A EA 序列, 另一个是Q W 特征序列[2]。
目前已经从不同植物中分离得到了4个编码OSC 酶的基因[16~
18]
#329#
4 五环三萜碳环的官能化反应与调控
五环三萜碳环系统合成后, 碳环骨架还必须经过复杂的修饰作用, 对这一过程的具体步骤还不十分清楚。大多数研究表明细胞色素P450依赖的单加氧酶和糖基转移酶参与了这一过程。细胞色素P450是一种以铁卟啉为辅基的b 族细胞色素, 大多数都催化羟化反应。典型的细胞色素P450包括A 、B 、C 、D 4个特征性结构域, 其中两个已被认为具有特殊功能[19]。Dur st 等[20]将细胞色素P450分为两个不同的组, 除了少数例外, A 组的P450都具有均一的特征性序列, 显示出参与催化植物特殊反应的特征, 参与五环三萜皂苷生物合成的P450应属于这组。非A 组的P450并非只局限在植物上发挥作用, 而是参与了生物体生命活动所必须的物质的合成。
催化五环三萜皂苷元与糖通过糖苷键相连的是糖基转移酶。它是具有众多成员的大家族, 具有高度的专一性。转移不同的糖基或糖基的受体不同, 所需的糖基转移酶也不同。已知序列的糖基转移酶没有明显的同源性, 但有相似的结构域。到目前为止, 仅有一种参与三萜皂苷生物合成的糖基转移酶被克隆出来[21]。5 结语
由于五环三萜皂苷结构复杂且类型众多, 经过大量的研究, 五环三萜皂苷生物合成代谢途径的研究取得了一定的进展, 但由于五环三萜皂苷的代谢是一个受多因素调节、非常复杂的动态变化过程, 距离完全破解该类物质的代谢途径尚有很多问题亟待解决, 如工艺流程复杂、成本高、易产生同分异构体及受环境污染等问题, 特别是五环三萜苷元碳环骨架建立后环上复杂的官能化反应过程尚不清楚, 使得现今利用代谢工程直接合成五环三萜皂苷还存在一定困难。
随着五环三萜皂苷类生物合成关键酶基因调控研究的不断深入, 阐明具有时空调控作用的各种顺式和反式作用因子, 分离具有组织特异功能的启动子, 实现五环三萜皂苷类相关代谢基因在特定组织或细胞中的定向表达, 确定五环三萜类次生物质代谢的关键酶基因及其协同性, 人工改造关键酶基因并使之高效表达, 进行细胞培养、生物转化、发根培养等工业化生产, 是实现大规模生产活性成分五环三萜皂苷类的可行方法。参考文献:
[1] 程晓华, 熊玉卿1五环三萜皂苷的药理作用研究进展[J ]1
中草药, 2007, 38(5) :792-7951
[2] 陈 莉, 吴耀生1三萜皂苷生物合成途径及相关酶[J ]1国
外医药:植物药分册, 2004, 19(4) :156-1611[3] Bach T J 1Some new as pects of is oprenoid b iosynthesis in
plants :a review [J]1L ip id s , 1995, 30:191-2021[4] M cgarvey D, Croreau R 1T erpenoid m etab olism [J]1Plant
Cell , 1995, 7:1015-10261
[5] Lichten th aler H K, Schw ender J, Dis ch A, et al 1Biosynthe -s is of is oprenoids in higher plant chloroplasts proceeds via a
m evalonate -in dependent pathw ay [J ]1FE BS L ett , 1997, 400(3) :271-2741
[6] Kajiw ara S, Fraser P D, Kond o K, et al 1Expr ess ion of an
exogen ou s is opentenyl diphosp hate isomerase gene en han ces isopren oid bios ynthes is in E sc herichia coli [J ]1B iochem J , 1997, 324(2) :421-4261
[7] S un Z R, Cunn ingham F X, Gantt E 1Differential expression
is , 即羽扇醇合成酶(lupeo l sy nthase, L S) 、B -香树脂
合成酶(B -amy rin synthase, B -A S) 、达玛烯二醇合成酶(dam -mar enedio l synthase, DS) 和环阿齐醇合成酶(cyclo artenol sy nt hase, CA S) , 其中前3个酶合成各类三萜类产物的前体, 第4个酶是甾醇的前体。由于大多数三萜类皂苷是从齐墩果烷(o leanane) 和达玛烷(dammarane) 衍化而来的, 因此B -AS 和DS 对三萜皂苷的合成非常重要。
Har alampidis 等[13]在研究与产物专一性有关的酶的结构域时发现, B -A S 的T rp 259通过齐墩果烷阳离子控制B -香树脂的形成; 高保守的T y r 261附近的氨基酸残基易于产生突变, 其突变导致五环三萜类转变为组氨酸, 而产生四环碳骨架的相应残基的突变导致了达玛烷型三萜类的合成。
到目前为止, 已经获得了几种多功能酶的克隆。如拟南芥A T L U P2和豌豆P SM , 两者表达产物可以催化生成五环三萜类物质, 前者产生羽扇豆醇、A -香树素及B -香树素, 后者6[2]。
#330#
中草药 Chinese Traditional and Herbal Drugs 第40卷第2期2009年2月
[15] 彭 剑, 龚炳永1角鲨烯环氧化酶抑制剂的研究进展[J ]1
国外医药:抗生素分册, 1998, 19(3) :177-1831
[16] C hoid W , J ung J , H a Y I, et al 1Analysis of trans cripts in
m ethyl jasmonate -treated ginseng hairy r oots to identify genes in volved in the b iosynthesis of ginsenosides and other seconda -ry metabolites [J]1Plant Ce ll Rep , 2005, 23(8) :557-5661[17] S uzuk i H , Achnin e L, Xu R, et al 1A gen om ics approach to
th e early stages of trirerpene s aponin biosyn th esis in M ed ica -go tr uncatula [J]1Plant J , 2002, 32(6) :1033-10481
[18] H ayas hin, Hu ang P, Inoue K 1U p regu lation of soyas aponin
b iosynthesis by methyl jasm onate in cultu red cells of G ly cyr-rhiz a g labra [J]1Plant Cell Phy siol , 2003, 44(4) :404-4111
[19] Kalb V F, Loper J C 1Proteins from eight eukaryotic cyto -chrome P -450families share a segmen ted region of s equence
similarity [J ]1P roc N atl Aca d S ci USA , 1988, 85(19) :7221-72251
[20] Durst F, Nelson D R 1Diversity an d evolution of plant P450
and P450-reductases [J]1Drug M etabol Dr ug I nteract , 1995; 12(3-4) :189-2061
[21] Ku rosaw a Y, T akahara H, Sh iraiw a M 1UDP -glu curonic
acid:soyasapog enol glucu ronosyltransferase in volved in sapo -nin bios ynthes is in germinating soybean seeds [J]1Planta , 2002, 215:620-6291
[8]
[9]
[10] [11] [12] [13] [14]
carotenoid accumulation in a unicellular chlorophyte [J ]1Pr oc
N at Ac ad S ci USA , 1998, 95(19) :11482-114881
C on cepcion R 1Gen etic eviden ce of b ranching in the isopren oid pathw ay for the production of isopentenyl diphosph ate an d dim ethylallyl diphosphate in E sc herichia coli [J]1FEB S L ett , 2000, 473(3) :328-3321
C hoi D, W ard B L, Bos tock R M 1Differen tial indu ction an d s uppression of potato 3-hydroxy -3-methylglutaryl coenzym e A r eductase genes in response to Phy top hthor a inf estan s and to its elicitor arachidon ic acid [J ]1P lant Ce ll , 1992, 4(10) :1333-13441
W an g G Y, Keasling J D 1Am plification of HM G -CoA r educ -tase production enhances caroten oid accumulation in Ne uros -p ora cr assa [J]1M etab En g , 2002, 4(3) :193-2011
孙彬贤, 翁颖琦, 刘 涤, 等1代谢中间产物和诱导子对南方红豆杉培养细胞生长和紫杉醇含量的影响[J]1上海中医药大学学报, 2000, 14(3) :54-561
J ung J D, Park H W , H ahn Y, et al 1Dis covery of gen es for gin sen os ide biosynth esis b y an alys is of ginseng ex pres sed se -quence tags [J]1Plant Ce ll Rep , 2003, 22(3) :224-2301邢朝斌, 王一曼, 陈正恒, 等1三萜皂苷的生物合成[J]1生命的化学, 2005, 25(5) :420-4221
赵明文, 钟家禹, 王 南, 等1鲨烯合酶的研究进展[J]1微生物学报, 2003, 43(5) :670-6761
日本药品进口程序及相关要求
罗 辉1, 于瑞钧2, 宋立平3, 马 军4, 江永萍3, 东 红3
*
(11天津中新药业药品营销公司, 天津 300457; 21天津劳动和社会保障局, 天津 300040; 31天津中新药业集团股份
有限公司达仁堂制药厂, 天津 300457; 41莱生(天津) 天然保健品开发有限公司, 天津 301700)
摘 要:日本是我国中药出口的第一大市场, 并且在将我国中医药推向国际市场方面, 日本也是首要选择的市场。通过对日本药品进口程序、各种申请及要求提交的资料进行介绍, 以期对我国药品出口日本有所裨益, 使中药能被接受认可。
关键词:日本; 药品; 进口程序
中图分类号:R956 文献标识码:A 文章编号:0253-2670(2009) 02-0330-04 日本是我国的近邻, 历史上深受中国文化的影响, 是中国中药出口的第一大市场, 并且在将我国中医药推向国际市场方面, 日本也是首要选择的市场。
中成药进入日本市场, 如果在日本厚生省规定的药局方中的汉方药210种处方之内, 则较易被批准, 如属新增的品种还要进行药理及临床复核试验, 审查期少则10个月, 多则几年, 费用上千万日元, 一经获准, 质量方面则要按申报标准严格把关执行。
曾对日本汉方药注册进行过简要介绍[1], 下面就日本药品进口程序及相关要求加以详细介绍, 以便国内企业开拓日本市场及医药界人士加以了解、借鉴。1 外国生产企业的各种申请
111 外国生产企业的认定申请:所谓外国生产企业即是指在外国想生产出口到日本的医药品的企业, 和日本国内生产企业一样需要厚生劳动大臣的批准。认定申请前, 外国生产
企业以及生产场所必须根据别纸样式1业者编码登记票进行登记。认定申请时, 根据施行规则样式第十六(二) 向机构提出认定调查申请书。注意必须在生产销售批准申请之前申请认定。申请手续、申请书的记载方法、提交资料见表1。112 外国生产企业认定区分变更/追加变更:认定区分追加申请是指外国生产企业取得认定后, 重新追加其他认定区分的申请; 认定区分变更申请是指废止已认定区分的同时, 重新追加其他认定区分的申请。申请手续、申请书的记载方法、提交资料见表1。
113 外国生产企业的认定更新申请:外国生产企业的认定有效期为5年, 如果到期不更新则自动失效。申请手续、申请书的记载方法、提交资料见表1。
114 外国生产企业的其他申请:关于外国生产企业认定的其他申请如变更申请、休止、废止、再开申请、许可证的再交付申请等按照日本国内生产企业的各申请的规定执行。
:
范文二:五环三萜皂苷的合成途径及生物活性研究进展
?60?
Jollnlal
ofHubei
湖北中医学院学报
Unive瑁畸ofChine∞Medici鹏
2010年6月第12卷第3期
June20lO。V01.12,No.3
【文献综述】
五环三萜皂苷的合成途径及生物活性研究进展
廖一帆
(湖北中医学院基础医学院20cr7级硕士研究生,湖北武汉430065)
关键词:五环三萜皂苷;生物活性;综述中图分类号:R284.3
文献标识码:A
文章编号:1008.987X(2010)03JD060旬3
五环三萜皂苷是由三萜皂苷元和糖经糖苷键连接而成的配糖体,大多以游离或苷类的形式广泛存在于自然界,许多中药如人参、甘草、三七、远志等都含有五环三萜皂苷成分。依据苷元的不同,五环三萜皂苷可分为齐墩果烷(ole粕柚e)型、乌苏
成2,3一氧化鲨烯。
ss和sE是此过程中关键的两个酶。在环丙甲醇二磷酸中问体介导下,SS催化两个法呢二磷酸(FPP)分子以头对头的形式形成还原性的二聚体p。。sE则催化鲨烯在C=C双键之间插入一个氧原子形成环氧化物p。。1.2氧化鲨烯环化酶(0sC)
合成二萜类皂苷的第一步就是OsC的环化作用。2,3一氧化鲨烯在0sc催化下,经过一系列的质子化作用、环化、重排和去质子化作用形成三萜皂苷元。大多编码Osc的基因是由5个蛇麻脂醇合成酶基因和7个公认的五环三萜合成酶基因组成的”1。0sC的活性与微体有关,揭示了它们与细胞膜结合的特性。0sc不可逆抑制和变异分析表明,高保守的氨基酸模体DcIAE是底物结合所需的p。。大多数植物三萜类皂苷是从齐墩果烷和达玛烷衍化而来的,因此B—AS和达玛烯二醇合成酶(Ds)对五环三萜皂苷的合成非常重要。
植物产生了大约∞多种不同的0sC产物,三萜类0sC的多作用特性和改变单个氨基酸序列就改变了产物的特性表明,天然结构多样性可能是由“灵活”酶的核心部位产生的。从2,3一氧化鲨烯形成的环化产物合成皂苷还需要额外的修饰,包括各种氧化、取代以及在骨架的不同位置上糖基化”。。1.3细胞色素P450
三萜环碳环系统合成后,碳环骨架还必须经过复杂的修饰作用,对这一过程的具体步骤还不十分清楚。大多数研究表明,细胞色素P450依赖的单加氧酶和糖基转移酶参与了这一过程。细胞色素P450是一种b族细胞色素,大多数都催化羟化反应。这种酶是
烷(u黜)型、羽扇豆烷(1up锄e)型和木栓烷(fhedeiam)型等
多种不同类型的化合物。在植物中,五环三萜皂苷的主要功能是防御病原体和害虫;现代药理研究表明它具有抗肿瘤等多种生物活性。由于自然界中很多具有重要价值的五环三萜皂苷往往产量很低,因而对于五环三萜皂苷人工合成的研究成为该领域的热门。现仅就五环三萜皂苷的合成途径及生物活性的研究概况综述如下。
l五环三萜皂苷的合成途径
首先甲羟戊酸(Mevalonic∞id)生成的异戊烯二磷酸(IPP)
在香草二磷酸合成酶(GPS)作用下首先形成香叶二磷酸(GPP),接着利用二磷酸合成酶(FPs)转化成二磷酸(FPP),又在鲨烯合成酶(ss)的作用下合成鲨烯,然后经鲨烯环氧酶(sE)催化转变为2,3一氧化鲨烯(2,3一馘id08quale∞)“。。2,3一氧化鲨烯经过2,3一氧化鲨烯环化酶(0sC)的环化作用得到三萜类骨架。三萜类骨架依赖细胞色素P450单加氧酶、糖基转移酶(cT)和B一糖苷酶进行氧化、置换及糖基化等化学修饰,最终获得五环三萜类皂苷产物。
1.1
甲羟戊酸
甲羟戊酸途径是公认的皂苷三萜苷元合成途径。异戊烯
二磷酸依次在香叶二磷酸合成酶(GPs)、法呢二磷酸合成酶(FPs)、鲨烯合成酶(sS)和鲨烯环氧酶(sE)的催化下,最终合
作者简介:廖一帆(1984一)。男。湖北中医学院基础医学院200r7级硕士研究生。
[1l】Meierc,st明bJJ。RotllcB,eta1.TsHThempy
Reduc∞
c蛐tmuedThyIoxil把
iII
[12]崔斌,黄岚,宋耀明,等.冠心病患者循环内皮祖细胞与尿酸检测及相关性[J】.中国动脉硬化杂志,2006。14(1):卯一∞.[13]成忠,彭定凤,余意君,等.血清尿酸水平与冠状动脉病变的相关性[J】.临床内科杂志,2004,21(11):777—778.
1收稿日期:加10一Ol一¨编辑:邵企红)
Chde咖{ol
Su址llic丑lIIypo£hyroidism
4860一4866.
跏Pto吣
a肪Ilbk鼬ld,PhcelⅪcon砌。d1h丑I
kvel5aIld
Clirlical
(Basellllymidstudy)[J].JcliIlE耐0rillolMetab,200l。86(10):
2010年6月第12卷第3期
JllIle2010,VoL
12,No.3
Jo哪a1
ofHubei
湖北中医学院学报
Univers时ofChinese
Medic沁
。6l?
膜定位蛋白,在细胞中的含量少且不稳定,很难提纯。直到1990年,第—个植物细胞色素P450才由燕麦果实中克隆出来”。。
通过密码和域的研究,Choi等¨。已经识别了25种细胞色素N50。其中一员包含在原人参萜二醇C一6位置上,催化形成原人参萜三醇(合成人参皂苷的主链)¨。。所识别的P450家族成员中,3个与cYP85A1家族(包含在油莱类固醇生物合成中)有高度的氨基酸序列同源性¨。。虽然许多酶有高度的底物专一性,但它们的同源就是由于有相似的底物化学结构“。。1.4糖基转移酶(GT)和B一糖苷酶
催化三萜皂苷元与糖通过糖苷键相连的是糖基转移酶。它是具有众多成员的大家族,具有高度的专一性。转移不同的糖基或糖基的受体不同,所需的糖基转移酶也不同。已知序列的糖基转移酶没有明显的同源性,但有相似的结构域。
从三萜苷元生物合成皂苷对于原人参萜二醇型骨架在C一3和C一20的羟基位置进行了糖基化,形成了原人参萜二醇型人参皂苷;而对于原人参萜三醇则在c一6和C一20位置上进行了糖基化,形成了原人参萜三醇型人参皂苷¨1。choi等”。用密码和域的研究,识别了5个B一糖苷酶候补物。有些人参皂苷山B一糖苷酶介导,裂解葡萄糖转变成其他的形式的皂苷。5个公认的B一糖苷酶中有3个编码的蛋白质与以前分离的酶(修饰呋甾烷苷和燕麦皂苷)相似。2五环三萜皂苷的生物活性
近年来,随着现代分离方法和结构测定技术的应用,三萜皂苷已成为天然产物研究中最活跃和进展最快的领域。大量的研究表明,五环三萜皂苷类化合物具有广泛的药理作用和重要的生物活性,尤其在抗炎、护肝、抗肿瘤以及机体免疫调节等方面备受人们的关注。2.1抗肿瘤活性
?
制¨“。菊科植物一枝黄花(岛脚n哂撇)中的三萜皂苷
VirgjⅡlreasaponinE可能通过促进血清肿瘤坏死因子TNF—q的
释放而抑制小鼠DBA/2一Mc、sC—l纤维肉瘤以及180纤维肉瘤的生长¨…。绞股蓝总皂苷经腹腔注射对小鼠kWis肺癌细胞具有明显的抑制作用”“。
从泻根(占,),Dn缸d幻玉口)的根中得到的三萜皂苷能很好地抑制11PA诱导的炎症反应,对11PA诱导的EB病毒早期抗原(EBV—EA)的半数抑制量为O.2—0.6IIg/ear。其中bryoni惦id鹤E显示出强烈的EBV—EA抑制作用,在1×10’molratio/-】甲^剂量时,抑制率可达到100%¨“。这类皂苷有望发展成为一类有效。的预防肿瘤药物。2.2护肝作用
研究表明,五环三萜皂苷化合物如熊果酸、齐墩果酸护肝效应的作用具体机制可能主要与其抗氧化、抗炎效应以及对药物代谢酶的作用有关。M毗ilI等¨到研究发现,熊果酸对CCl‘诱导的抗氧化酶改变有保护作用,能明显抑制由CCl4诱导的小鼠血清丙氨酸氨基转移酶(ALT)和天冬氨酸基转移酶(AsT)的升高。同时也能逆转过氧化物歧化酶、过氧化氢酶、谷光甘肽还原酶及谷光甘肽过氧化物酶的活性。以及保持谷光甘肽体内水平。体外实验中,对于由ccl.诱导中毒的肝细胞,熊果酸能显著降低谷草转氨酶及乳酸脱氢酶活性,并且发现熊果酸在羟基化后具有很强的自由基清除活性。2.3抗炎作用
研究表明,大多数五环三萜皂苷具有抗炎作用,并已应用于
临床。B棚。等唧。对枇杷提取物的研究发现其中大约有10余种
五环三萜皂苷对由.Ⅱ,A诱导的小鼠的耳水肿以及由其诱导的Raji细胞中E—B病毒早期抗体的活化具有明显的抑制作用,这可能与抑制髓过氧化物酶活性有关,并能使Raji细胞存活率更高。考察某些五环三萜皂替结构变化对其抗炎活性的影响,结果表明齐墩果酸以及其类似物C一3氧化后对5一脂氧化酶和体内的炎症过程具有更强的抑制作用H“。桦木酸及其衍生物则能通过抑制炎症过程中具有重要作用的磷脂酶A2(PLA:)的活性,从而抑制炎症进展…1。Isma甜圳从唇形科百里香属植物7A妒叫
2.1.1体外活性:五加科植物波斯常春藤(执幽伽如^池)中
具有新结构的齐墩果酸单糖苷(Hedercolchiside)A对肺癌A549
等6种肿瘤细胞系均有细胞毒效应,其IC如从4.5岫oL/L到
12Ⅳ∞L/L不等,构效关系研究表明其q位苷化,且糖的连接次序为O—q—L吡喃鼠李糖(1—观)一Ⅸ一L毗喃阿拉伯糖是保持
活性的基本结构单元p1。西南银莲花(An唧。地如”谈iF删nch)
中的3个三萜皂苷对人癌细胞体外生长有抑制作用”…。紫金牛科紫金牛属植物九节龙(Ardb∞pⅪ以缸)中的2个九节龙皂苷
6r0珊sD,let“和z"d№矗枝叶氯仿提取物中分离得到具有抗
炎活性的主要化学成分为齐墩果酸和熊果酸。2.4抗病毒作用
据报道,五环三萜皂苷甘草酸苷对sARs病毒复制具有非常强的抑制作用,且选择性抑制指数很高。甘草酸苷不仅抑制病毒的复制,而且在病毒复制早期还能抑制病毒的吸附和穿膜,因此其在病毒的吸附期及吸附期以后都是非常有效的。目前,
(ardipusiuoside)对小鼠肉瘤(S180)、小鼠艾氏腹水癌(队c)、
黑色素瘤(B16)以及小鼠肝癌(HEPA)均有抑制作用”“。
人参皂苷Rh。及其前体Rg。对小鼠宫颈癌(U14)和EAc有明显的抑制作用,具有很强的抗肿瘤作用,R_ll。抗肿瘤作用强于Rg。¨“;其二醇组皂苷Rh:经研究具有很高的抗肿瘤活性,对癌症细胞具有分化诱导、增殖抑制和诱导细胞凋亡等作用¨“。此外人参皂苷可通过阻止细胞增殖周期的Go/G,期或促使细胞死亡两种方式抑制肿瘤细胞U20s的增殖””。
2.1.2体内活性:据报道,移植了卵巢癌的裸鼠经腹膜内给予人参皂苷Rk,并同时给予顺铂(cisplatin),结果两者合用较之单用时,小鼠的生存时间明显延长,而肿瘤的生长受到明显抑
甘草酸苷的抗sAl玛病毒的作用机制仍不完全明确,推测其可能的作用机制是影响细胞的信号传导通路。陈国宝等”。研究发现,从番石榴叶中提取的熊果酸具有降低轮状病毒的能力,减弱其感染力,增强MA一104细胞抗轮状病毒感染的作用,同时对感染轮状病毒的MA一104细胞,也有明显的治疗作用。2.S其他生物活性
五环三萜皂苷其他生物活性包括心血管系统作用,如抗高
?62?
湖北中医学院学报
2010年第12卷第3期
血压、抗动脉粥样硬化、抗心律失常以及调脂、降糖等作用‘251。五环三萜皂苷对由环磷酰胺诱发的心脏毒性以及红藻氨酸盐诱导的小鼠海马神经元兴奋性中毒具有显著的保护作用。同时,能对抗由化学药物或胃酸分泌过多所致的胃溃疡,提高慢性胃损伤的治愈率汹埘1。3讨论
五环三萜皂苷具有广泛的生物活性和药理作用,尤其是抗肿瘤和抗病毒的作用,为其开发应用治疗AIDS、肿瘤等奠定了理论根据。另外五环三萜皂苷在心脑血管疾病方面的应用,也将有助于寻找和发现更有效的用于治疗心脑血管疾病的天然药物,应用前景广阔。
由于五环三萜皂苷结构复杂且类型众多,目前对其生物合成具体步骤仍不十分明了,合成途径会遇到工艺流程复杂、成本高、易产生同分异构体及受环境污染等问题。为此,进一步深入研究五环三萜皂昔的合成途径,不仅对于基础研究,而且对于增加中药有效成分的产量,实现工业化生产,提高社会和经济效益,都具有重要意义。参考文献:
[1]
JulIgJD,ParkHw,HallnY,毗aLD缸co他Iy0fbi06yntll∞i8byanalysis0fgh鸵ngCeu
[11]李茂,李伟芳,覃良,等.九节龙皂甙体内的抗肿瘤作用[J].广
西中医学院学报,2004,7(2):1l—12.
[12】
陈志武,王岩,王毅,等.人参皂苷Rgl和RhI抗肿瘤作用的研究[J].吉林大学学报(医学版),2003,29(1):25—28.
[13]
赵越,苏适.人参皂苷Rh2抗肿瘤作用的研究[J].微生物学杂志,2003,23(2):6l一63.
[14]张有为,空城德强,陈英杰,等.人参皂苷对人体骨肉将为细胞u20s增殖的影响[J].中草药,200l,32(3):232—235.
[15]
ⅪkllcK
oeu
Y,S嘲H,l(imT。et
aL
hIIIibi曲n
ofhufr蛐ovari粕啪∞r
pm陆ra£i∞访t讥by百m啪池Rh2“岫uv珊拯熵幻
[16]
cisplati咖讯咖[J].A埘canc盯Dmg,1991,2(1):63—67.
P10hm蚴B,Bad盯G,HillerK,etaLI唧u∞mduI咖ry如d8nthmrale如ctsoft血em∞id∞p∞妇【J].Ph∞n峨,199r7,52
(12):953—957.
刘痪,汪平君,许伏新.胶股蓝总皂苷抑制小鼠kwis肺癌生长与提高免疫力研究[J】.安徽中医学院学报,2001,20(1):43—44.
[17]
[18]Ukiya
M,从hiHT,Y粕uk鲫a
Nal
砌一tIl啪f
[19]
plDm幽g胡k协of叫cIlrbita鹏dy∞Bid伪钿mtlIe触
Prod,2002,65(2):179一183.
S,de
K。daLAlni—i枷枷m砒ofy蚰d
of奶m函如蛔[J].J
gen∞如r舀I№Il∞ide
expr啷∞d5代一eIl∞扭挚[J].1哩卸t
[2]删itJ,肪m妨DE,Schtllte
瓢plalene
Rep,2003,22(3):224—230.
GK,e£aLcfyBtal
laB}王era鼻B,S蚰dlez—R蛐MI。etaL
Ph蚰rmcologic丑l删正训onofend0罾叫锄60五damen珂m髓byur蜘hc扯idtet嫩hiodde埘ucedli代rd姗ageiIlr8ts粕dprimBry
on
Mamn一蛳n
s拄uc£L聪0fhu删
[20]
cukumoftal
199—206.
hep8呐[J].E砷ToxicolPaM,200l,53(2—3):
tlle
symk龄一AkcyemymincholegIcmIbi∞ynth∞iB[J].J
B“Chem。2000。275:30610—30617.[3]s、1踟kiH,khnineL,xuR。etaLA
stag瞄of证tc‘pencHpolIiIl
B咖o
N,AkihiBaT。T0kudaH,etaLAlIti一枷啪malory拍d
l蛆v∞0f
geI删砸∞app眦htotheeady
bi∞ynth髓i5iIIMedicagomIn咖l丑[J].
P.MolecularclorliIIg
觚tihlm盯一pmr∞血g疆bc协oftlIe证terpen档如m
Eriborbryaj8ponica[J].Biol
1999.
Ph蚰BlIIl,2005,28(10):1995一
aL
Pl∞tJ。2002。32:1033—1048.
[4]
Huml8teiII—Mllll盱T,SchllerH,Bclm幽ter
[21]
‰一h髓删,MaI船S。№MC,d
Bema耐P,SciorT,Didi盯B,etaLbioillfonr咀吐c
∞mbiImtion
如r
Ieads
0J棚唧ljc∞id,a
3一
州expre鹋ion
ilI
ye船tof2,3一仳id∞qu且lene—mterpenoid
cyBl蜊
of
∞函terp咖缸“p幽cia。谪幽协砒砌enegyIId岫“llas枷一
如m^柚池p“‘诎讧M[J].Pl蚰t
MolBiol,2001,45:75—92.
AE
Bi∞yntlI%i8
i加amloIy删哪[J].kJHlammc0I。瑚1,428(1):137—143.
[22]
Ethnoph蚰他coloF锄d
to
[5】Haml枷pidi5x,Tmj蚰wsk丑M,osbum
2002,75:3l一49.
斑te‘pe加id髓polli珊iIlplan协[J].AdyBi∞hemEllgBiot优hnol,
di5∞"ry:appHl嫩ion
ph∞ph“pa∞A(2)inhibito口[J].Phytoche曲try,2001,58(6):
865—874.
[6]Bo翻lkKR,YuH。s沁’agR,etaLSeqllen∞alI丑ly8面《fiPeniIlg一
他kedcy眦hro雠P一450
cDNAs如m帅cB如h血[J].P眦Nad
AnaIysi80f缸an∞r:iPts
[23]
AcadSciUSA。1990。87:3904—390暇.
∞tiv畸of“嗽and∞ml埘llldshDm乃胛6删mo似越[J].J
PII㈣P}lamac01.2002,54(8):1137一1140.
陈国宝,陈宝田.番石榴叶提取物体外抗轮状病毒的实验研究【J].中国医药学报,2002,17(8):502—504.
Is瑚ili
H。So蛆S,BrkicD,et且L
ToPical柚ti—in丑舳咖协Iy
[7]clloiDw,JulIgJ,HaYI,etaL
j酗肿n曩te一仃e砒ed咖ng}lairy
CcURep,2005,23:557—566.
iIlⅫ妯yl
iII
rDot5to
identi每gen∞ilIVolVed
tlle
[24]
bi∞yIItll础ofg.m∞r,∞ides蛐datller搴econdary
[8]
ShiII璩da
metabom∞[J].Plant
[25]
Y,Fujiokas,MiyauclIiN,融aLBra鹪ill∞temid一6—
Ca“y研MuhipleC一6
[26]
va帅地l蚴t
R0drigIl龆一Rodrigu%R,Hen_em
e伍∞协ofole且noHc
MD,Pe胁Js,etaL凡她nti丑I
acid
and
crytll∞一diol,two
0】【ida5%如mAmhidopsis&IldTo仃Iato
仃iteqm∞ids∞ntailledin‘omjo’oh"o丑,∞呲∞眦[J].BrJNu打,2004,92(4):635—642.
sud蛐帅Pr,MYtIIiliY,SdlvaI【um盯E,et,a1.Lnpeol¨d沁es时
0xidati咖inBra∞iMlemid
126:770—779.
Bi循ylltIle8i8[J].Pk叫Pllysiol,2001,
[9]
Bardlo嘁缸C,Debi协nE,Mshvidad∞V,etaL赢豳uac_d咖of
[27]
唧u0眦cmecyclph∞ph“dep咖∞ked
studide
ill
caIdiac
lyB∞olIlaldaⅢ学
Hedemcolch埘d射咖pa捌’rith
otller飘poIli璐丘Dm麒娩m∞‘c艄∞
l曩t[J].MolcellBi∞hem,2006,282(1—2):23—29.
q芦if埘pmlifbr砒i叽ofhumanca地i∞m&柚d
‰Med,2002,醅(8):672—675.
草药。2∞1,32(6):493—496.
m妇。眦oells[J].
RodrigIl龆JA,A曲Idillo扯id
L,Schm。d丑一Hi触hn删∞G-0l啪0lic
chIDllic即曲赴l髑i咖
p。鲫m鹪heahng
ofa∞tjc扯id一垴duoed
【10]廖循。李伯刚,高小平,等.西南银莲花的活性三萜皂苷[J].中
jn舳[J].n蝴I呦l‰。2003,48(3):29卜294.
(收稿日期:2∞9一12一船编辑:任桂华)
范文三:五环三萜皂苷的药理作用研究进展
?792?中草药 Ch i nese Traditional and Herbal D rugs 第38卷第5期2007年5月
五环三萜皂苷的药理作用研究进展
程晓华, 熊玉卿
Ξ
(南昌大学医学院临床药理研究所, 江西南昌 330006)
摘 要:五环三萜皂苷是天然产物中重要的成分之一, 大多具有广泛的药理活性, 临床应用前景十分诱人。随着五环三萜皂苷研究的不断深入, 对其药理学作用机制的阐明和新药研发已成为此类化合物研究的热点之一。就国内外学者对五环三萜皂苷抗肿瘤、护肝、抗炎、以及机体免疫调节等药理学作用的研究进展做一综述。关键词:五环三萜皂苷; 抗肿瘤; 抗炎
中图分类号:R 282171015 文献标识码:A 文章编号:0253-2670(2007) 05-0792-04
Advances i n stud ies on pharmacolog ica l activ of sapon i n s
CH EN G X , 2(Institute of C linical Phar m , edical N , N anchang 330006, Ch ina )
Key :; o r ; an tiinflamm ati on
, 大多以游离或苷类的形式广泛存在于自然界。依据苷元的不同, 五环三萜皂苷可分为齐墩果烷型、乌苏烷型、羽扇烷型、木栓烷型等多种不同类型的化合物。大量的研究表明, 含五环三萜母核的皂苷化合物具有广泛的药理作用和重要的生物活性, 尤其在抗炎、护肝、抗肿瘤以及机体免疫调节等方面已经显现出令人关注的药理特性。近些年来, 国内外学者围绕五环三萜皂苷的药理学作用机制和新化合物结构发现与分析做了大量的研究, 并取得了丰硕的成果, 这些成果亦展示了五环三萜皂苷广泛的应用前景, 为五环三萜皂苷的综合开发利用提供了可靠的实验依据。笔者查阅了近10年来有关五环三萜皂苷药理学研究方面的相关文献, 进行归纳, 为该类化合物进一步研究、开发和利用提供参考。
1 抗肿瘤活性
H epG 2细胞凋亡的研究中发现, 熊果酸以浓度和时间依赖
性方式明显降低H epG 2细胞活力, 而且30Λmo l L 熊果酸能够诱导DNA 断裂和亚二倍体细胞的生成以及提高细胞色素
C 释放和凋亡蛋白酶CPP 3的活力, 这些结果说明熊果酸诱
导的细胞凋亡可能是通过细胞色素依赖的CPP 3活性介导的。L i 等[2]研究熊果酸和齐墩果酸对人直肠癌细胞HCT 15的抑制作用, 研究发现两者半抑制浓度分别为60、30Λmo l
L , 熊果酸比齐墩果酸对HCT 15细胞毒性强。细胞增殖实验
表明二者均以浓度依赖方式明显抑制HCT 15的活力及其增殖, 形态学上也发生显著的变化。通过给予半抑制浓度的两种药物36h 和72h 后伴随S 期细胞数量的减少, G 0 G 1期细胞也逐渐下降, 但没有检测到细胞凋亡碎片。Park 等[3]研究发现亚细亚草酸能以时间、剂量依赖方式降低黑色素瘤SK 2
M EL 22细胞活力并诱导其凋亡, 这种凋亡机制可能通过提
肿瘤是一种多因素所致的疾病, 通常认为肿瘤的发生发展一般要经历大致3个阶段:始发突变、促癌、演变。由于引起肿瘤的因素很多, 抗肿瘤机制非常广泛, 如激活细胞凋亡因子; 抑制生长因子或信号传导因子的表达; 下调抗细胞凋亡蛋白; 抑制肿瘤血管增生; 在分子水平调节磷酯酰肌醇23’2激酶、N F 2?B 的表达等。因此, 如果药物能够在肿瘤发生任何阶段产生某种机制就可能达到预防或抑制肿瘤发生的目的。
111 对肿瘤细胞的细胞毒作用:很多肿瘤的发生发展与细
高细胞内反应性细胞氧簇的水平及调整Bax Bcl 22比率和
CPP 3活性。线粒体在细胞凋亡过程中占有重要地位, 羽扇
豆烷型皂苷桦木酸及其衍生物通过降低恶性黑色素瘤细胞线粒体膜电位, 使线粒体膨胀破坏, DNA 断裂而致细胞死亡[4]。
112 抑制肿瘤新生血管的生成:病理性血管生成在实体瘤的
快速发展甚至于肿瘤从原发部位转移起着有非常重要的作用, 而在肿瘤新生血管的形成过程中, 血管内皮细胞的活化、增殖、迁移及小管形成是其关键步骤。通过药物抑制血管内皮细胞的增殖、迁移和小管形成可有效阻止新生血管的形成, 进而可有效抑制肿瘤的生长和转移。熊果酸是很强的血管生成抑制剂, 它对血管形成的抑制是多方面的, 如抑制V EC 增殖、迁移及小管形成等。Sohn 等[5]通过鸡胚绒毛膜实验模型发现
胞增殖和死亡平衡失调有关, 临床上治疗肿瘤所应用的许多手段, 如化疗、放疗、激素治疗、热疗以及常采用的药物治疗等, 其作用机制之一是诱发肿瘤细胞凋亡, 抑制肿瘤的生长, 当前有关五环三萜皂苷对肿瘤细胞的细胞凋亡作用研究以熊果酸研究较广。K i m 等[1]在对熊果酸诱导人肝毒细胞瘤
Ξ
收稿日期:2006208231
作者简介:程晓华(1981—) , 男, 江西余干人, 南昌大学医学院2004级在读硕士, 研究方向为药物代谢及药动学。
T el :(0791) 6360654 E 2m ail :cxh 0204032@163. com
3通讯作者 熊玉卿 T el :(0791) 6360654 E 2m ail :xyq 1126@yahoo . com . cn
中草药 Ch i nese Traditional and Herbal D rugs 第38卷第5期2007年5月
熊果酸和齐墩果酸以剂量依赖方式抑制血管生成的每一阶段, 半数最高抑制剂量(I D 50) 分别为5Λg 和40Λg , 而且能以浓度依赖方式抑制牛动脉血管内皮细胞增殖。Cardenas 等[6]在离体实验研究中也发现熊果酸能抑制血管生成的每一个关键步骤, 如内皮细胞的增生、迁移、分化, 同时刺激间质金属蛋白酶和尿激酶所致的细胞外基质的降解。
113 抗肿瘤多药耐药和肿瘤逆转作用:肿瘤细胞对药物产
?793?
应的作用具体机制还不甚明确, 但其作用机制可能主要与其抗氧化、抗炎效应以及对药物代谢酶的作用有关。M artin 等[13]研究发现, 熊果酸对CC l 4诱导的抗氧化酶改变有保护作用, 能明显抑制由CC l 4诱导的小鼠血清丙氨酸氨基转移酶(AL T ) 和天冬氨酸基转移酶(A ST ) 的升高。同时也能逆转过氧化物歧化酶、过氧化氢酶、谷光甘肽还原酶及谷光甘肽过氧化物酶的活性, 以及保持谷光甘肽体内水平。体外实验中, 对于由CC l 4诱导中毒的肝细胞, 熊果酸(500mmo l L ) 能显著降低谷草转氨酶及乳酸脱氢酶活性(P <0. 01)="" ,="" 并且发现熊果酸在羟基化后具有很强的自由基清除活性。研究表明熊果酸能以浓度依赖方式明显抑制由ca="" 2+诱导的肝线粒体肿胀、线粒体屏障蛋白丢失、基质c="">
生耐药性是药物治疗肿瘤失败的主要原因之一, 据不完全统计, 90%接受化疗的肿瘤患者的死亡与耐药有关, 因此抗肿瘤耐药是当前成功治疗肿瘤的关键。而许多恶性肿瘤能在某种体内外分化诱导剂存在的情况下向正常组织细胞进行分化而产生肿瘤逆转效应。齐墩果Fernandes 等[7]通过桦木酸、酸、果树酸3种五环三萜皂苷对K 562长春新碱抵抗的细胞
L ucenal 1的活性进行实验研究, 由于K 562长春新碱抵抗的
E 1进行代谢, 因CC l 42E , 用, 因而会产生护肝作用, 另外也有学者研究证实, 这两种五环三萜类皂对CYP 2E 1不能产生抑制效应[15], 因此有关CYP 酶系统对五环三萜皂苷护肝效应的具体机制还有待进一步探索。
3 抗炎、抗病毒作用
细胞L ucenal 1是一种能过度表达P 胞, , 3, P 糖蛋白的表达无关。L ee 等[8]F 9畸胎瘤细胞转变为内胚层细胞, 并且引起与其分化有关的 型胶原以及维甲酸受体表达增加, 而且能致M I 细胞分化成为巨噬细胞。熊果酸诱导癌细胞分化成正常细胞的机制可能与其结构上类似于糖皮质激素, 从而与糖皮质激素受体或类似的核受体结合发挥作用有关。
114 抗肿瘤的分子机制:肿瘤发生过程包括细胞转化、过度
大量实验研究表明, 大多数五环三萜皂苷具有抗炎作用, 并已应用于临床。Banno 等[16]对枇杷E riobotry a jap onica
(T hunb 1) L indl 1提取物的研究发现其中大约有10余种五环三萜皂苷对由T PA 诱导的小鼠的耳水肿以及由其诱导的
R aji 细胞中E 2B 病毒早期抗体的活化具有明显的抑制作用,
增殖、侵袭、血管生成、转移。许多基因都能介导由转录因子
N F 2?B 调节的肿瘤细胞发生过程, 因此抑制N F 2?B 的活性
这可能与抑制髓过氧化物酶活性有关, 并能使R aji 细胞存活率更高。考察某些五环三萜皂苷结构变化对其抗炎活性的影响, 结果表明齐墩果酸以及其类似物C 23氧化后对52脂氧化酶和体内的炎症过程具有更强的抑制作用[17]。桦木酸及其衍生物则能通过抑制炎症过程中具有重要作用的磷脂酶A 2
(PLA 2) 的活性, 从而抑制炎症进展[18]。Is m aili [19]研究表明
就可能达到抑制肿瘤发展的目的。熊果酸能抑制多种与癌基因相关基因的表达, 抑制由多种致癌物如佛波酯(T PA ) 、
H 2O 2等诱导N F 2?B 的活性。有学者研究发现熊果酸通过抑
制N F 2?B 组成成分p 50与p 56的DNA 结合、I ?2B Α降解和磷酸化以及通过TN F 受体途径抑制依赖于N F 2?B 受体基因表达的活性, 从而抑制与N F 2?B 活性有关的细胞周期蛋白D 1、基质金属蛋白酶9, 且没有肿瘤细胞特异性[9]。You COX 22、
等[10]研究发现熊果酸以剂量依赖方式提高NO 和肿瘤坏死
) 产生数量及i 因子(TN F 2ΑN O S 和TN F 2ΑmRNA 的水平, 在N F 2?B 结合位点瞬间表达和电泳迁移率变动分析实验发现i N O S 和TN F 2ΑmRNA 的水平的提高是由N F 2?B 转录因子
从唇形科百里香属植物T hym us broussonetii 和T 1w illd e 2
no w ii 枝叶氯仿提取物中分离得到具有抗炎活性的主要化学
成分为齐墩果酸和熊果酸。德国法兰克福大学医学院和医学病毒学研究院的科学家们应用V ERO 细胞在体外对62氮尿苷、利巴韦林、吡唑呋喃菌素、甘草酸苷和麦考酚酸5种药物进行了抗SA R S (重症急性呼吸综合征) 相关冠状病毒(SA R S 2实验结果表明[20], 利巴韦林和麦考酚酸CV ) 的研究。不会影响SA R S 病毒复制, 62氮鸟苷和吡唑呋喃菌素在非毒性剂量范围内能够抑制病毒的复制, 但抑制指数较低, 而五环三萜皂苷甘草酸苷对SA R S 病毒复制则具有非常强的抑制作用, 且选择性抑制指数很高。甘草酸苷不仅抑制病毒的复制, 而且在病毒复制早期还能抑制病毒的吸附和穿膜, 因此其在病毒的吸附期及吸附期以后都是非常有效的。目前, 甘草酸苷的抗SA R S 病毒的作用机制仍不完全明确, 推测其可能的作用机制是影响细胞的信号传导通路, 如蛋白激酶酪氨酸激酶 、转录因子(如激活蛋白I 和核因子?C 、B ) 。陈
复合物介导的熊果酸诱导的, 这些结果说明熊果酸抗肿瘤作用机制可能是刺激NO 和TN F 2Α的释放和在静息巨噬细胞中N F 2?B 的转录活性上调i N O S 和TN F 2ΑmRNA 的表达。熊) 果酸通过上调凋亡蛋白(Fas A po 21、Fas 配体、Bax 、I ?2B Α及抑制抗凋亡因子(BCL 22、BCL 2X 2、N F 2?B p 65) 的表达对人小细胞肺癌细胞A 549产生细胞效应[11]。Zou 等[12]研究表明齐墩果酸衍生物诱导肺癌细胞和白血病细胞凋亡机制可能主要与M A P 激酶途径介导有关。
2 护肝效应
目前, 五环三萜皂苷化合物如熊果酸、齐墩果酸护肝效
?794?中草药 Ch i nese Traditional and Herbal D rugs 第38卷第5期2007年5月
2181
[6] Cardenas C , Q uesada A R , M edina M A 1Effects of urso lic
acid on different step s of the angi ogenic p rocess [J ]1B ioche m B iop hy s R es Co mm un , 2004, 320(2) :40224081
[7] Fernandes J , Castilho R O , da Co sta M R , et a l 1Pentacyclic
triterpenes from Ch rysobalanaceae species :cyto toxiccity on m ultidrug resistant and sensitive leukem ia cell lines [J ]1Cancer L ett , 2003, 190(2) :16521691
[8] L ee H Y , Chung H Y , K i m K H , et a l 1Inducti on of diferen 2
tiati on in the cultured F 9teratocarelnom a stem cells by triter 2pene acids [J ]1J Cancer R es C lin O ncol , 1994, 120(9) :51625231
[9] Sh ish ir S, SekharM , Sanjeev B 1U rso lic acid inh ibits nuclear
facto r 2?B activati on induced by carcinogenic agents th rough supp ressi on of I ?B Αk inase and p 65pho spho rylati on :co rrela 2ti on w ith dow n 2regulati on of cyclooxygenase 2, m atrix m etal 2lop ro teinase 9, and cyclin D 1[J]1Cancer R es , 2003, 6:4375243831
[10] You H J , Cho i C Y , K i m J Y , et U rso lic acid enhances
nitric and r r 2alpha p roducti on via r 2resting m acrophages J F L ett , 156[]Y L , P L , L C P liferative inh ibiti on , cell 2
, and inducti on of apop to sis by urso lic acid an non 2s m all cell lung cancer A 549cells [J ]1L if e S ci , 2004, 75:2303223161[12] Zou W , L iu X , Yue P , et a l 1c 2Jun N H 22ter m inal k inase 2m e 2
diated up 2regulati on of death recep to r 5contributes to induc 2ti on of apop to sis by the novel synthetic triterpeno id m ethyl 222cyano 23, 122di oxoo leana 2192dien 2282oate in hum an lung can 2cer cells [J ]1Cancer R es , 2004, 64(20) :7570275781 [13] M artin 2A ragon S , de las H eras B , San chez 2R eusM I , et a l 1
Phar m aco logical modificati on of endogenous an ti oxidant en 2zym es by urso lic acid on tetrach i o rlde induced liver dam age in rats and p ri m ary cultures of rat hepatocytes [J ]1E xp T ox i 2col P a thol , 2001, 53(223) :19922061
[14] T ang X , Gao J , Chen J , et a l 1Inh ibiti on of urso lic acid on
calcium 2induced m itochondrial per m eability transiti on and re 2lease of two p roapop to tic p ro teins [J ]1B ioche m B iop hy s R es Co mm un , 2005, 337(1) :31023241
[15] K i m K A , L ee J S , Park H J , et a l 1Inh ibiti on of cytoch rom e
P 450activities by o leano lic acid and urso lic acid in hum an liv 2er m icro som es [J ]1L if e S ci , 2004, 74(22) :2769227791[16] Banno N , A k ih isa T , Tokuda H , et a l 1A nti 2inflamm ato ry
and antitumo r 2p romo ting effects of the triterpenes from the leaves of E ribortry a jap on ica [J ]1B iol P ha r m B u ll , 2005, 28(10) :1995219991[17] Giner 2L arza E M , M anezs S , R eci o M C , et a l 1O leanonic
acid , a 32oxo triterpene from p istacia , inh ibits leuko triene synthesis and has anti 2inflamm ato ry activity [J]1E u r J P ha r m acol , 2001, 428(1) :13721431
[18] Bernard P , Sci o r T , D idier B , et a l 1E thnophar m aco logy and
bi o info r m atic com binati on fo r leads discovery :app licati on to pho spho li pase A (2) inh ibito rs [J ]1P hy toche m istry , 2001, 58(6) :86528741
[19] Is m aili H , So sa S , B rk ic D , et a l 1Top ical anti 2inflamm ato ry
activity of extracts and compounds from T hym us broussonettii [J ]1J P ha r m P ha r m acol , 2002, 54(8) :1137211401
[20] C inatl J , M o rgenstern B , Bauer G , et a l 1Glycyrrh izin , an
active component of liquo rice roo ts , and rep licati on of SA R S 2associated co ronavirus [J ]1L ancet , 2003, 361(9374) :2045220461
[21] Chen B G , Chen B T 1Experi m ental study on antivitrial ac 2
tivities of the extract from P sid ium g ua ijava L 1against ro 2tavirus in v itro [J ]1J Ch in M ed (中国医药学报) , 2002, 17(8) :50225041
[22] H uang L , Chen C H 1M o lecular targets of anti 2H I V 21triter 2
penes [J ]1Cu rr D rug T a rg ets Inf ect D isord , 2002, 2(1) :332361
[23] A iken C , Chen C H 1Betulinic acid derivatives as H I V 21an 2
() []1, 2005, 111:312361tivirals J T rend s M ol M ed
[24] Rodriguez 2Rodriguez R , H errera M D , Perona J S , et a l 1Po 2
tential vaso relaxant effects of o leano lic acid and eryth ro 2di o l , two triterpeno ids contained in ‘o ruj o ’o live o il , on rat ao rta [J ]1B r J N u tr , 2004, 92(4) :63526421
宝国等[21]研究发现从番石榴叶中提取的熊果酸具有降低轮状病毒的能力, 减弱其感染力, 增强M A 2104细胞抗轮状病毒感染的作用, 同时对感染轮状病毒的M A 2104细胞有明显的治疗作用。当前大量有关五环三萜类皂的抗H I V 作用研究表明, 其作用机制可能主要与以下因素有关[22,23]:①阻断病毒的吸附或膜的融合; ②抑制逆转录; ③H I V 蛋白酶的抑制; ④抑制病毒分化成熟; ⑤其他机制。
4 其他药理学作用
近年来, 有关五环三萜皂苷一些新药理学作用的研究成绩斐然, 包括心血管系统作用, 如抗高血压、抗动脉粥样硬化、抗心律失常以及调脂、降糖作用[24,25]等。五环三萜皂苷对由环磷酰胺诱发的心脏毒性以及红藻氨酸盐诱导的小鼠海马神经元兴奋性中毒均具有显著的保护作用[26,27]。熊果酸等通过提高胆碱能的转运抑制乙酰胆碱酯酶的降解, 有望成为当前治疗老年痴呆的一个重要途径[28]。, [29; [30]5 结语
, 分布广泛, 资源丰富。多年来, 关于五环三萜皂苷的结构和活性研究积累了丰富的经验。尤其是抗肿瘤作用机制研究非常广泛, 在抗肿瘤药物的筛选中也获得了不少有活性的化合物, 而且这些化合物抗肿瘤作用呈现多部位、多环节、多靶点的特点, 既能使药物长时间持续发挥效力, 又能使患者带瘤生存时间延长, 最新研究表明它还能对抗当前致肿瘤治疗失败的肿瘤耐药机制, 使其有望成为新一代的抗肿瘤。当前有关艾滋病的预防和治疗已成为人类所面临的巨大难题, 随着中药的现代化, 中医药治疗艾滋病已取得长足的发展, 尤其是五环三萜皂苷在抗
H I V 研究在近几十年已有很大进展, 大量的研究发现其在
抗H I V 的治疗上已经可以和目前市面上有效的抗H I V 主导药物药效相媲美, 是一种非常具有潜力的抗H I V 药物, 具有广阔的开发和应用前景。但由于五环三萜皂苷生产工艺的复杂、药理学作用机制不够明确、体内生物利用度低, 使其在临床上运用还不够广泛。近年来, 五环三萜皂苷体内药动学研究已日趋活跃, 了解药物体内代谢后结构的变化与疗效和毒性间的关系, 发现并确定产生药理作用的物质基础, 掌握药物代谢规律, 为设计更合理的给药途径、给药方法、给药剂量, 以及新药结构和制剂的改良启迪新思路。
References :
[1] K i m D K , Baek J H , Kang C M , et a l 1A pop to tic activity of
urso lic acid m ay co rrelate w ith the inh ibiti on of initiati on of DNA rep licati on [J ]1In t J Cancer , 2000, 87(5) :62926361[2] L i J , Guo W J , Yang Q Y 1Effects of urso lic acid and o leano 2
lic acid on hum an co lon carcinom a cell line HCT 15[J ]1W orld J Gastroen terol , 2002, 8(3) :49324951
[3] Park B C , Bo sire K O , L ee E S , et a l 1A siatic acid induces
apop to sis in SK 2M EL 22hum an m elanom a cells [J ]1Cancer L ett , 2005, 218(1) :812901
[4] L iu W K , Ho J C , Cheung F W , et a l 1A pop to tic activity of
betulinic acid derivatives on m urine m elanom a B 16cell line [J ]1E u r J P ha r m acol , 2004, 498(123) :712781
[5] Sohn K H , L ee H Y , Chung H Y , et a l 1A nti 2angi ogenic ac 2
tivity of triterpene acids [J ]1Cancer L ett , 1995, 94(2) :2132
中草药 Ch i nese Traditional and Herbal D rugs 第38卷第5期2007年5月
[25] Somova L O , N adar A , R amm anan P , et a l 1Cardi ovascular ,
antihyperilp idem ic and anti oxidant effects of o leano lic and ur 2so lic acids in experi m ental hypertensi on [J ]1P hy to m e 2d icine , 2003, 10(223) :11521211
[26] Sudharsan P T , M yth ili Y , Selvakum ar E , et a l 1L upeo l and
its ester am eli o rate the cyclopho spham ide p rovoked cardiac lyso som al dam age studied in rat [J ]1M ol Cell B ioche m , 2006, 282(122) :232291
[27] Sh ih Y H , Chein Y C , W ang J Y , et a l 1U rso lic acid p ro tects
h i ppocampal neurons against kainate 2induced excito toxicity in rats [J ]1N eu rosci L ett , 2004, 362(2) :13621401
?795?
[28] Chung Y K , H eo H J , K i m E K , et a l 1Inh ibito ry effect of
urso lic acid purified from O rig anum m ajorana L 1on the acetylcho linesterase [J ]1M ol Cells , 2001, 11(2) :13721431[29] Rodriguez J A , A studillo L , Schm eda 2H irschm ann G 1
O leano lic acid p romo tes healing of acetic acid 2induced ch ronic gastric lesi ons in rats [J ]1P ha r m acol R es , 2003, 48(3) :29122941
[30] R aphael T J , Kuttan G 1Effect of naturally occurring triter 2
peno ids glycyrrh izic acid , urso lic acid , o leano lic acid and nom ilin on the i m m une system [J ]1P hy to m ed icine , 2003, 10(627) :48324891
中药提取物防潮制剂技术研究进展
刘 怡, 冯 怡3, Ξ
(上海中医药大学, 况下, 分? 。中药制剂研究及, 存在问题较多, 大部分中药制剂是以中药原药材粉末或提取浸膏为原料制备的常规制剂。如《中国药典》2005年版一部的成方制剂和单味制剂中, 浸膏
(包括半浸膏) 制剂和全粉末制剂占了85. 16%。中药提取浸
, 无需粉碎的优点。
112 转运困难:随着药品生产技术装备的发展, 固体物料也
可以实现管道转运。但中药提取物粉体吸湿后, 黏性增大, 聚结成团, 流动性下降, 并且易于黏附在容器的器壁上, 转运十分困难, 也带来较大的损耗。
113 制粒困难:中药提取物由于吸湿性强, 制粒过程也十分
困难。在湿法搅拌制粒时, 必须加入大量的辅料才能使制粒过程顺利进行。当辅料用量受限时, 必须用高体积分数的乙醇制粒, 此时增加了生产成本, 而且还带来一定的危险性[1]。喷雾干燥制备的中药浸膏粉由于吸湿性强, 制粒时成粒困难, 颗粒中有条状物产生, 粒径分布悬殊, 干燥后较硬[2]。挤出制粒时, 由于提取物吸湿, 软材紧密聚结, 而大量黏附在筛网上, 使得生产过程中需频繁更换筛网, 制粒过程损耗大, 产品得率低, 并且颗粒中有较多的色深质硬的粒子, 溶解性差。流化床制粒在一定程度上适用于吸湿性强的中药提取物的制粒, 但由于有的中药提取物吸湿性过强, 在流化床中沸腾时与具有一定湿度的空气充分混合而吸湿, 相互聚集成团, 使沸腾停止而造成“塌床”。
114 制丸困难:喷雾干燥制备的中药浸膏粉采用流化床技
膏是一个多成分的复杂体系, 但仍表现出一定的粒径、流动性、可压性以及黏性、吸湿性等物理特性, 其中吸湿性显现得较为突出, 它可能直接影响中药提取物的粒径、流动性、可压性和黏性等物理特性。吸湿性强的物料会造成制剂成型工艺极为困难, 是长期以来影响中药制剂过程及其质量的一个主要问题。
1 吸湿性对中药制剂过程及产品的影响
在化学合成药物中, 影响药物吸湿性的主要因素是其化学组成及其结构。含有易形成氢键基团的化合物具有较强的吸湿性; 化合物晶型不同, 吸湿性也不同。而中药提取物中由于富含糖类、树脂、鞣质等极易吸湿的物质, 另外一些小分子生物碱也具有较强的吸湿性, 因此, 大多数中药提取物因吸湿而导致具有较强的黏性, 形成块状物, 给制剂过程带来较大困难, 并且对最终制剂产品质量稳定性有着较大的负面影响。
111 中间体存贮困难:中药提取物溶液经喷雾干燥得到的
术制备微丸时, 由于吸湿性强, 粉末极易黏附于锅壁或黏连成团块状, 甚至成稀糊状, 不能成型[3]。
115 充填胶囊困难:由于易吸湿, 宁泌泰胶囊在填充时经常
出现黏连, 造成粒重不稳定, 空心胶囊浪费严重, 生产不能按计划进行, 严重影响产品质量, 物耗、能耗无法控制[4]。
116 压片困难:压片时, 由于中药粉体吸湿性强, 产生较强
粉体, 溶解性好, 粒度均匀细腻, 可不经粉碎过筛而直接用于后期的制剂成型过程。但在生产实际中, 由于喷雾干燥的中药提取物粉体吸湿性非常强, 在存贮过程中易吸湿而结块, 严重者整个容器内的粉体成为一个结实的块状物, 甚至难以从容器中取出。因此, 喷雾干燥得到的中药浸膏粉在用于后期的制剂前往往还必须经过粉碎过筛, 从而失去了喷雾干燥
的黏性, 极易发生黏冲、拉冲现象。一方面, 制得的片剂表面不光滑, 严重者表面会有凹痕; 另一方面, 对压片机冲模的磨损较大, 严重者压片时发生冲杆与导轨碰撞断裂的现象。此外, 拉冲时下冲的上下运动受阻, 颗粒的填充不稳定, 使得压
Ξ
收稿日期:2006208212
作者简介:刘 怡(1976—) , 男, 江西南昌人, 在读博士研究生, 研究方向:中药制剂关键技术。
T el :(021) 51322491 E 2m ail :liuw alter @sohu . com
3通讯作者 冯 怡 T el :(021) 51322493 E 2m ail :fyi @vi p . sina . com
范文四:第八章+三萜皂苷
第八章 三 萜 皂 苷
(一)单型题
1. 不适用于粗总皂苷分离的方法是
A. 分段沉淀法 B. 胆甾醇沉淀法 C. 铅盐沉淀法
D. 正丁醇萃取法 E. 色谱法
2.有关人参皂苷叙述错误的是
A. 全植物含皂苷量花蕾>须根>主根
B. A型、B型苷元是达玛烷型衍生物
C. C型是齐墩果酸的双糖链苷
D. A型、B型有溶血作用,C型有抗溶血作用
E. A型在酸水解过程中易转变为人参二醇
3.有关皂苷的氯仿-浓硫酸反应叙述正确的是
A. 应加热至80℃,数分钟后出现正确现象
B. 氯仿层呈红色或篮色,硫酸层呈绿色荧光
C. 振摇后,界面出现紫色环
D. 氯仿层呈绿色荧光,硫酸层呈红色或篮色
E. 此反应可用于纸色谱显色
4.Liebermann-Burchard 反应所使用的试剂是
A. 氯仿-浓硫酸 B. 冰醋酸-乙酰氯 C. 五氯化锑
D. 三氯醋酸 E. 醋酐-浓硫酸
5.属于达玛烷衍生物的是
A. 猪苓酸A B. 菝葜皂苷 C. 熊果酸
D. 人参二醇 E. 甘草酸
6.下列成分的水溶液振摇后能产生大量持久性泡沫,并不因加热而消失的是
A. 蛋白质 B. 黄酮苷 C. 蒽醌苷
D. 皂苷 E. 生物碱
7.分段沉淀法分离皂苷是利用总皂苷中各皂苷
A. 在甲醇中溶解度不同 B. 极性不同 C. 酸性强弱不同
D. 易溶于乙醇的性质 E. 难溶于石油醚的性质
8.制剂时皂苷不适宜的剂型是
A. 片剂 B. 糖浆剂 C. 合剂
D. 注射剂 E. 冲剂
9.下列皂苷中具有甜味的是
A. 人参皂苷 B. 甘草皂苷 C. 柴胡皂苷
D. 知母皂苷 E. 桔梗皂苷
(二)配伍题
A. 人参皂苷A 型 B. 柴胡皂苷 C. 猪苓酸
D. 熊果酸 E. 薯蓣皂苷
1.属于α-香树脂烷型的是
2.属于β-香树脂烷型的是
3.属于羊毛脂甾烷型的是
4.属于达玛烷型的是
5.属于异螺旋甾烷型的是
A. 人参皂苷A 型 B. 柴胡皂苷a
C. 二者均有 D. 二者均无
6.属于羊毛脂甾烷型的是
7.属于β-香树脂烷型的是
8.具有抗溶血作用的是
9.属于达玛烷型的是
A
10.属于双糖链皂苷的是
(三)多选题
1.皂苷在哪些溶剂中溶解度较大
A. 热水 B. 含水稀醇 C. 热乙醇
D. 乙醚 E. 苯
2.可以用于皂苷元显色反应的试剂是
A. 醋酐-浓硫酸 B. 冰醋酸-乙酰氯 C. 苦味酸钠
D. 三氯醋酸 E. 五氯化锑
3.属于四环三萜皂苷元结构的是
A. 羽扇豆烷 B. 羊毛脂甾烷
C. 达玛烷 D. β-香树脂烷
4.有关甘草皂苷叙述正确的是
A. 酸性皂苷
B. 可用做食品工业甜味剂
C. 又称甘草次酸
D. 属于五环三萜皂苷元结构
E. 水提液振摇后可以产生大量泡沫
5.皂苷多具有下列哪些性质
A. 吸湿性 B. 发泡性 C. 无明显熔点
D. 溶血性 E. 味苦而辛辣及刺激性
6.精制皂苷时,先将粗皂苷溶于甲醇或乙醇,然后加何溶剂可使皂苷析出
A. 乙醚 B. 水 C. 正丁醇
D. 丙酮 E. 乙醚-丙酮(1﹕1)
(四)填空题
1.皂苷因其水溶液经振摇能产生( )而得名。以皂苷为主要成分的天然产
物有( )、( )、( )和( )等。
2. 皂苷可以被水解。随水解条件不同,产物可以是 ( )、( )和 ( )。可导致皂苷元发生脱水、环合等变化的是( )条件下水解,酯苷键只需( )条件即可水解。
3.甘草皂苷在植物体内以 ( ) 盐形式存在,易溶于。从甘草中提取的甘草酸不易精制,一般通过制成( )后才能得到精制品。甘草皂苷在( )条件下水解可以得到甘草皂苷元,又称 ( ),有( )和( )两种构型,其中有促肾上腺皮质激素样生物活性的是 ( )。
4.分子中有羧基的皂苷称 ( );皂苷元上羧基与糖缩合而成的苷称( );双糖链皂苷是指( )。
参 考 答 案
(一):
1D 2D 3D 4E 5D 6D 7B 8D 9B
(二):
1D 2B 3C 4A 5E
6D 7B 8A 9A 10A
(三):
1ABC 2ABDE 3BC 4ADB 5ABCDE 6ADE
(四):
1.持久性的泡沫 人参 甘草 柴胡 麦冬
2 .次生皂苷 苷元 糖 _酸水解 NaOH/H2O
3.钾盐或钙 铵盐 酸性 甘草次酸 18β-H 18-αH 18β-H。
4.酸性皂苷 酯皂苷 两个羟基和两个糖链形成的苷 。
范文五:三萜皂苷的生物合成[1]
● Current Topics
《 生命的化学 》 2005年 25卷 5期
CHEMISTRY OF LIFE 2005, 25(5)
文章编号 :1000-1336(2005)05-0420-02
三萜皂苷的生物合成
邢朝斌 王一曼 陈正恒 沈海龙
1
(华北煤炭医学院生物科学系 , 唐山 063000;
1
东北林业大学林学院 , 哈尔滨 150040)
摘要 :异 戊 烯 二 磷 酸 在 香 叶 二 磷 酸 合 成 酶 、 法 呢 二 磷 酸 合 成 酶 、 鲨 烯 合 成 酶 和 鲨 烯 环 氧 酶 催 化 下 合 成 2,3-氧
化鲨烯 , 再经氧化鲨烯环化酶催化形成各种三萜类 , 三萜类经细胞色素 P450、 糖基转移酶和 β-糖苷酶的修饰 , 形成各种类型的三萜皂苷 。 关键词 :
三萜皂苷 ; 氧化鲨烯环化酶 ; 糖基转移酶 ; β-糖苷酶
中文分类号码 :Q946
—— — — — — — — — —
— 收稿日期 :
2005-06-06
国家 “ 十五 ” 科技攻关子课题资助项目 (No. 2001BA510B0801) 作者简介 :
邢朝 斌 (1975— ) , 男 , 硕 士 , 讲 师 , 联 系 作 者 ,
E-mail :xingzhb@mail.edu.cn
皂苷 (saponin ) 一词由 sapo 演化而来 , 也就是
拉丁语的肥皂 (soap ) , 因为在水溶液中 , 这些分 子有表面活化剂的特征且有像肥皂一样的泡沫 [1]。 三萜皂苷是一种重要的植物次生代谢产物 , 广泛 分布于植物界中 , 有抗菌和抗虫害的作用 [1,2]。 三 萜皂苷可用作药物 , 能抗胆固醇血症 、 抗癌 、 辅 药和有溶血活性 [3], 具有重要的商业价值 。
目前对三萜皂苷的生物合成途径已有一定的 了 解 。 首 先 通 过 甲 羟 戊 酸 途 径 合 成 2,3-氧 化 鲨 烯 , 随后在氧化鲨烯环化酶 (OSC ) 的作用下形成 各种三萜类 , 最后经细胞色素 P450、 糖基转移酶 (GT ) 和 β-糖 苷 酶 的 作 用 , 形 成 了 各 种 类 型 的 三 萜皂苷 (图 1) 。 1. 甲羟戊酸途径
甲羟戊酸途径是公认的皂苷三萜苷元合成必 由 途 径 [5]。 异 戊 烯 二 磷 酸 依 次 在 香 叶 二 磷 酸 合 成 酶 (GPS ) 、 法 呢 二 磷 酸 合 成 酶 (FPS ) 、 鲨 烯 合 成 酶 (SS ) 和 鲨 烯 环 氧 酶 (SE ) 的 催 化 下 , 最 终 合 成
2,3-氧 化 鲨 烯 [4]。 此 过 程 中 , SS 和 SE 是 最 关 键
的两个酶 。
在环丙甲醇二磷酸中间体介导下 , SS 催化两
图 1
植物三萜皂苷的生物合成途径 [4]
MVA , 甲 羟 戊 酸 ;
IPP , 异 戊 烯 二 磷 酸 ;
GPP , 香 叶 二 磷 酸 ;
FPP , 法 呢 二 磷 酸 ; GPS , 香 叶 二 磷 酸 合 成 酶 ;
FPS , 法 呢 二
磷酸合成酶 ;
SS , 鲨烯合成酶 ; SE , 鲨烯环氧酶 ;
CAS , 环
阿 屯 醇 合 成 酶 ; β-AS , β-香 树 脂 合 成 酶 ; DS , 达 玛 烯 二 醇
合成酶 ;
GT , 糖基转移酶 [4]。 图 中 实 线 为 已 公 认 的 合 成 途 径 ;
虚线为尚未得到公认的合成途径 。
个法呢二磷酸 (FPP ) 分子以头对头的形式形成还 原性的二聚体 [6]。 Suzuki 等 [3]用 14C-FPP 、 NADPH 和 Mg 2+检测 SS 活性时发现 , 在转导空载体的大肠
杆菌提取物中没有 14C-鲨烯产物的形成 , 而在转 导含 SS 的 pET15b 的大肠杆菌提取物中发现了标 记 性 产 物 ; 然 而 去 掉 NADPH 时 , 却 根 本 没 有 鲨 烯产物的形成 ; 没有 Mg 2+离子的条件下 , 鲨烯的
[8]
Lin SY et al. Dev Cell, 2003, 4:639— 650
[9]Song JJ et al. Nature Struct Biol, 2003, 10:1026— 1032[10]Tang G. Sci, 2005, 30:106— 114
[11]Schwarz DS et al. Cell, 2003, 115:199— 208[12]
Khvorova A et al. Cell, 2003, 115:209— 216
[13]Bartel B et al. Plant Physiol, 2003, 132:709— 717[14]Martinez J et al. Genes Dev , 2004, 18:975— 980[15]Martinez J et al. Cell, 2002, 110:563— 574[16]Nykanen A et al. Cell, 2001, 107:309— 321[17]
Pham JW et al. Cell, 2004, 117:83— 94
420? ?
● 知识介绍
《 生命的化学 》 2005年 25卷 5期 CHEMISTRY OF LIFE 2005, 25(5)
合 成 也 显 著 下 降 。 继 续 研 究 SS 反 应 时 还 发 现 , Mn 2+、 Co 2+和 Fe 2+能替代 Mg 2+作为反应中的辅助因 子 , 但 Ca 2+、 Cu 2+和 Zn 2+却不能 。
SE 催 化 鲨 烯 在 C=C 双 键 之 间 插 入 一 个 氧 原 子形成环氧化物 [3]。 在研究人参皂苷合成时 , Choi 等 [5]识别了三 个 编 码 SE 的 转 录 物 , 这 表 明 在 人 参 基 因 组 中 SE 形 成 了 一 个 小 的 多 基 因 家 族 。 Suzuki 等 [3]通过 DNA 琼脂印迹分析 , 在苜蓿基因 组中发现了 两 个 SE 基 因 (SE1和 SE2) 。 它 们 编 码的蛋白 SE1和 SE2与 人 参 公 认 的 SE 关 系 非 常 密 切 , 分 别 有 77.1%和 74.4%的 序 列 一 致 性 。 用 甲基茉莉酸 (methyl jasmonate, MeJA ) 处理苜蓿后 SE1转录物并没有被诱导 , 而 SE2转录物的诱导 率却很高 , 表明 SE2并不是 SE1, 其在合成三萜 类过程中起到了重要的作用 。
2. 氧化鲨烯环化酶 (OSC )
生物合成三萜类皂苷的第一步就是 OSC 的环 化作用 。 大多编码 OSC 的基因是由 5个蛇麻脂醇 合成酶基因和 7个公认的五环三萜合成酶基因组 成的 [7]。 目前已经从各种不同植物中分离得到了 3个编码 OSC 的基因 [β-香树脂合成酶 (β-AS ) 、 蛇 麻脂醇合成酶 (LS ) 和环阿屯合成酶 (CAS ) ][5]。 OSC 的活性与微体有关 , 揭示了它们与细胞膜结合的 特性 。 OSC 不可逆抑制和变异分析表明 , 高保守 的氨基酸模体 DCTAE 是底物结合所需的 [1]。 大多 数植物三萜类皂苷是从齐墩果烷和达玛烷衍化而 来的 [1], 因此 β-AS 和达玛 烯 二 醇 合 成 酶 (DS ) 对 三萜皂苷的合成非常重要 。
目 前 已 经 从 人 参 和 豌 豆 中 得 到 了 两 个 与 β-AS 相似的酶 [8,9], 其能催化氧化鲨烯产生单个的环 化产物 [1]。 Haralampidis 等 [1]在研究与产物专一性 有关的酶的结构域时发现 , β-AS 的 Trp 259通过齐 墩 果 烷 阳 离 子 控 制 β-香 树 脂 的 形 成 ; 高 保 守 的 Tyr 261附近的氨基酸残基易于产生突变 , 其突变导 致五环三萜类转变为组氨酸 , 而产生四环碳骨架 的相应残基的突变导致了达玛烷型三萜类的合成 。 产生原人参萜二醇的 DS 目前还没有被识别 , 然而这些 OSC 酶的氨基酸序列彼此同源 , 因此通 过氨基酸序列的同源比较 , 分离生物合成三萜类 皂苷的 DS 候补物并不困难 [5]。
植 物 产 生 了 大 约 80多 种 不 同 的 OSC 产 物 , 三萜类 OSC 的多作用特性和改变单个氨基酸序列 就改变了产物的特性表明 , 天然结构多样性可能 是由 “ 灵活 ” 酶的核心部位产生的 [1]。
从 2,3-氧化鲨烯形成的环化产物合成皂苷还 需要额外的修饰 , 包括各种氧化 、 取代以及在骨 架的不同位置上糖基化 [1]。
3. 细胞色素 P450
通过密码和域的研究 , Choi 等 [5]已经识别了 25种 细 胞 色 素 P450。 其 中 一 员 包 含 在 原 人 参 萜 二醇 C-6位置上 , 催化形成原人参萜三醇 (合成 人参皂苷的主链 ) [4]。 所识别的 P450家族成员中 , 3个与 CYP85A1家族 (包含在油菜类固醇生物合 成中 ) 有高度的氨基酸序列同源性 [10]。 虽然许多酶 有高度的底物专一性 , 但它们的同源就是由于有 相似的底物化学结构 [5]。
4. 糖基转移酶 (GT ) 和 β-糖苷酶
从三萜苷元生物合成皂苷对于原人参萜二醇 型骨架在 C-3和 C-20的羟基位置进行了糖基化 , 形成了原人参萜二醇型人参皂苷 ; 而对于原人参 萜 三 醇 则 在 C-6和 C-20位 置 上 进 行 了 糖 基 化 , 形成了原人参萜 三 醇 型 人 参 皂 苷 [4]。 Jung 等 [4]用 密码和域研究 , 识别了 74个糖苷转移酶候补物 , 这 些 重 叠 群 集 合 形 成 42个 独 特 的 糖 苷 转 移 酶 候 补物 。 然而有 12个与植物次生代谢产物葡萄糖基 转移酶 (PSPG ) 序列一致的 EST 在植物次生代谢产 物合成的糖苷转移酶中已被发现 。 Choi 等 [5]从人 参 EST 数据组中识别了 9个糖苷转移酶基因 , 其 中有 5个与 PSPG 有 共 同 结 构 域 , 在 植 物 次 生 代 谢产物合成的糖苷转移酶中也有所发现 。 糖苷转 移 酶 的 预 计 氨 基 酸 序 列 含 有 一 个 UDP-结 合 区 , 其与来自哺乳动 物 特 殊 甾 类 的 UDP-糖 苷 转 移 酶 相似 [1]。 到 目 前 为 止 才 分 离 得 到 了 一 个 编 码 皂 苷 糖基转移酶 (StSGT ) 基因 [5]。 对于已识别的糖苷转 移酶候补物 , 其作用特征正在研究之中 。
Choi 等 [5]用密码和域的研究 , 识别了 5个 β-糖苷酶候补物 。 有些人参皂苷由 β-糖苷酶介导 , 裂解葡萄糖转变成其他的形式的皂苷 。 5个公认 的 β-糖苷酶中有 3个编码的蛋白质与以前分离的 酶 (修饰呋甾烷苷和燕麦皂苷 ) 相似 。
综上所述 , 目前对三萜皂苷的生物合成途径 和合成中所需的酶尚了解较少 , 这主要是由于对 代 谢 途 径 中 间 体 和 分 子 的 复 杂 性 缺 乏 基 础 研 究 。 三萜皂苷有一定的药理作用和商业价值 , 因此有 必要进一步研究三萜皂苷的生物合成途径 , 了解 生物合成的基因 , 从而工业化生产三萜皂苷 。
参 考 文 献
421? ?
● Current Topics
《 生命的化学 》 2005年 25卷 5期
CHEMISTRY OF LIFE 2005, 25(5)
文章编号 :1000-1336(2005)05-0422-03
小分子 GTP 酶的结构与功能
董玖红 文建凡
(中国科学院昆明动物研究所细胞与分子进化重点实验室 , 昆明 650223)
摘 要 :小 分 子 GTP 酶 是 真 核 生 物 中 普 遍 存 在 的 一 类 分 子 量 较 小 的 蛋 白 质 , 它 们 具 有 保 守 的 GTP 结 合 结 构 域 ,
在 GTP 酶类中自成一个超家族 。 根据序列结构的不同它们又分为多个家族 , 不同的家族分别在诸如细胞信号转 导 、 胞质骨架的建成和物质转运等过程中起着非常重要的调控功能 。 关键词 :
小分子 GTP 酶 ;
GTP 结合结构域 ; 细胞调控功能
中图分类号 :Q55
—— — — — — — — — —
— 收稿日期 :
2005-05-30
国家自然科学基金资助项目 (No. 90408016, 30021004) 作者简介 :
董玖红 (1978— ) , 女 , 博士生 , E-mail :djhcn
@126.com ; 文 建 凡 (1965— ) , 男 , 博 士 , 研 究 员 , 联 系 作 者 ,
E-mail :wenjf@mail.kiz.ac.cn
小分子 GTP 酶广泛存在于真核生物中 , 是一
类分子量为 20~40kD 的单体 GTP 结合蛋白 , 又名 小分子 G 蛋白 、 小分子 GTP 结合蛋白和 Ras 蛋白 超家族 [1]。 它们本身的 GTP 酶活性很低 , 需要 GTP 酶激活蛋白 (GAP ) 的参与 , 与 GTP 和 GDP 的结合 与释放也需要鸟苷酸交换因子 (GEF ) 的作用 [2]。
目前在真核生物中已鉴定了超过 100多种的 小分子 GTP 酶 , 根据序列结构特征 , 这些蛋白质 被 分 为 5个 家 族 :Ras 、 Rho 、 Rab 、 Sar1/Arf 和
Ran [1]。 序列排比表明 , 不同物种的小分子 GTP 酶 之间有 30%~55%的同源性 。 Ras 家族内各成员之 间有较高的序列一致性 (达 50%) ; Rab 和 Rho 家 族 与 Ras 家 族 成 员 之 间 有 30%的 一 致 性 [1]。 尤 其 是 , 所有这些蛋白都具有高度保守的 GTP 结合结 构域 (GTP-binding domain ) 。 1. 结构
对多种小分子 GTP 酶晶体进行的核磁共振分 析表明 , 整个家族的蛋白质都具有一个 20kD 的
GTP 结合结构域 (简称 G 结构域 ) [1,2]。 该结构域由 5个 α螺 旋 (A1~A5) 、 6个 β折 叠 (B1~B6) 和 5个环 (loop ) (G1~G5) 构成 (图 1) 。 其中的 5个环是
G 结构域中最保守的结构元件 。
G1环 [GXXXXGK(S/T) , 也叫 P-环 ]连接 B1折 叠和 A1螺旋 , 与 GTP 或 GDP 的 α和 β磷酸基团 结合 。 G2环 (XTX ) 连接 A1螺旋和 B2折叠 , 其保 守的苏氨酸与 Mg 2+结合 。 G3环 (DXXG ) 位于 A2螺旋的 N 端 , 主要功 能 是 与 GTP 或 GDP 的 γ磷 酸基团及 Mg 2+结合 。 G4和 G5环的主要功能是识 别鸟苷酸的鸟嘌呤 。 G4环 [(N/T)(K/Q)XD]的天冬 酰氨和赖氨酸直接与核苷酸结合 ; G5环 位 于 B6和 A5之间的部分氨基酸也负责识别鸟嘌呤 。
Ras ? GDP ? Mg 2+和 Ras ? GppCp ? Mg 2+的晶体结构 相比较揭示出两个区域在 GTP 的结合与水解过程 中调节酶分子的结构变化 [1](图 1) 。 一个是 switch I , 与 G2环 有 关 ; 一 个 是 switch II , 由 G3环 和 部 分 A2螺 旋 构 成 。 Switch I 也 被 称 为 效 应 环 (effector loop ) , 因为它是效应因子和 GAP 的结合
位点 。
各家族成员的晶体结构比较表明 , G1磷酸识 别环和 G4核苷酸识别环最为保守 , 而 G2Mg 2+识 别环和 G3γ磷酸基团识别环较为多变 [1]。 构 象 的 不同直接影响了不同 GTP 酶与一系列效应因子的 结合能力和 GTP 水解活性 。 2. 功能
小分子 GTP 酶的生物功能在很大程度上依赖 于其翻译后加工 。 例如 , 很多 Ras 和 Rho 蛋白在
C 端都有 CAAX (C=半胱氨酸 , A=芳香族氨基酸 ,
[1]
Haralampidis K et al. Adv Biochem Eng Biotechnol, 2002, 75:31— 49
[2]Papadopoulou K et al. Proc Natl Acad Sci USA, 1999, 96:
12923— 12928
[3]Suzuki H et al. Plant J, 2002, 32:1033— 1048[4]Jung JD et al. Plant Cell Rep, 2003, 22:224— 230[5]
Choi DW et al. Plant Cell Rep, 2005, 23:557— 566[6]Pandit J et al. J Biol Chem, 2000, 275:30610— 30617
[7]Husselstein-Muller T et al. Plant Mol Biol, 2001, 45:75— 92[8]Kushiro T et al. Eur J Biochem, 1998, 256:238— 244[9]Morita M et al. Eur J Biochem, 2000, 267:3453— 3460[10]
Shimada Y et al. Plant Physiol, 2001, 126:770— 779
422? ?
转载请注明出处范文大全网 » 五环三萜皂苷生物合成与调控的



 风过胯下蛋蛋凉
风过胯下蛋蛋凉

