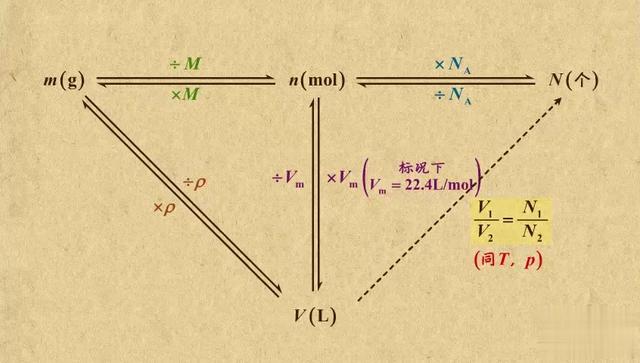
范文一:平均摩尔质量专题
平均摩尔质量 专题
1、下列各组气体混合后,得到的混合气体的平均式量可能为40的是A
(A)CO2和CO (B)SO2和CO2 (C)N2和CO (D)N2和O2
2.在标准状况下,气体A的密度为1.25g/L,气体B的密度为1.875g/L,A和B的混合气体在相同状况下对氢气的相对密度为16.8,则混合气体中A与B的体积比为D
A.1:2 B.2:1 C.2:3 D.3:2
3. 某混合气体中各气体的质量分数为O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,则此混合气体对氢气的相对密度为B
A.32.00 B.11.11 C.22.22 D.30.00
4.在150℃时碳酸铵完全分解产生的气态混合物其密度是相同条件下氢气密度的C
A、96倍 B、48倍 C、12倍 D、32倍
5、某物质A在一定条件下加热分解,产物都是气体。分解方程式为2A==B+2C+2D。测得生成物的混合气体对氢气的相对密度为d,则A的式量为B
A.7d B.5d C.2.5d D.2d
6. CO和CO2的混和气体平均分子量为32,则混和气体中CO和CO2的质量比是B
A.1:3 B.21:11 C.11:21 D.3:1
7.在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,此混合气体中C和O两种原子的物质的量之比为 A
A.3:4 B.4:3 C.2:1 D.1:2
8.由等体积的H2、O2、N2、CO组成的混和气体的质量是13.5克,其中O2的质量是A
A.4.8克 B.3.2克 C.6.4克 D.8克
9.由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为 CD
A.29:8:13 B.22:l:14 C.13:8:29 D.26:16:57
10.由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对空气的相对密度为1.293,则原混和气体中H2所占的体积分数为A
A、1/6 B、2/3 C、1/4 D、1/3
11.一定温度下,物质W分解,其反应方程式4W X3(g)+2Y(g),测得生成物组成的混合气体与H2的相对密度为18,则W的相对分子质量为 A
A. 27 B. 18 C. 36 D. 126
-112、由CH4和O2组成的混合气体,标准状况下的密度为1g.L,则该混合气体中CH4和O2的体积比
为 D
A.2:1 B.1:2 C.2:3 D.3:2
13.V2O3和V2O5按不同的物质的量之比混合可按计量发生完全反应。今欲制备V8O17,则V2O3和V2O5的物质的量之比应为C
A. 1:2 B. 2:1 C. 3:5 D. 5:3
14. 按体积比为4:3:3所组成的N2、O2、CO2,混合气体100g在标准状况下体积为___ L。 ( 65.88)
15.在臭氧发生器中装入氧气100 mL。经反应3O2??2O3,最后气体体积变为95 mL(均在标准状况下测定),则混合气体的密度是B
A.1.3 g/L B.1.5 g/L C.1.7 g/L D.2.0 g/L
守恒法
1.在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR。则在此反应中Y和M的质量之比为A
(A)16:9 (B)23:9 (C)32:9 (D)46:9
2.现有A、B、C三种化合物,各取40g相混合,完全反应后,得18gB,49gC,还有D生成。已知D的相对分子质量为106。现将22gA和11gB反应,能生成D的物质的量为D
(A)1mol (B)0.5mol (C)0.275mol (D)0.25mol
3.在无土栽培中,需配制一定量含50mol NH4Cl、16mol KCl和24mol K2SO4的营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)B
A.2、64、24 B.64、2、24 C.32、50、12 D.16、50、24
4.15gA物质和10.5gB物质完全反应后,生成7.2gC物质、1.8gD物质和0.3gmolE物质,则E的摩尔质量是C
A.100 g/mol B.111 g/mol C.55 g/mol D.27.5 g/mol
5.在一定容积的容器中,加入a摩氙气和b摩氟气,在2635千帕和400℃下加热数小时后迅速冷却至室温,除剩余b/2摩氟气外,还得到一种无色晶体,则所得无色晶体中,氙与氟的原子个数比为 B
A.a:b/2 B.a:b C.4a:b D.a:2b
6.已知有反应2NO+O2==2NO2。今在体积为VL的密闭容器中通入amolNO和bmolO2。反应后容器中的氮原子和氧原子的原子个数之比是C
A. a/b B. a/2b C. a/(a+2b) D. a/(2a+2b)
7. 有一在空气中暴露过的KOH固体,经分析其内含有水7.62%,K2CO32.38%,KOH90%,若将此样品1 g加入到2mol/L盐酸40.00mL里,过量的酸再用0.107mol/L KOH溶液中和,蒸发中和后的溶液可得到的固体 A ( )
A、5.96g B、4.00g C、4.5g D、无法计算
8.在CO和CO2的混合气体中,氧元素的质量分数为64%。将该混合气体5 g通过足量的灼热的氧化铜,充分反应后,气体再全部通入足量的澄清石灰水中,得到白色沉淀的质量是C
A.5 g B.10 g C.15 g D.20 g
-12--9、用1L 1.0mol·LNaOH溶液吸收0.8molCO2所得溶液中CO3 和HCO3 的物质的量浓度之比
是A
A.1:3 B.2:1 C.2:3 D.3:2
10、超导材料是具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3OX。现欲合成0.5mol此高温超导物,依化学剂量比例,需取Y2O3、BaCO3和CuO的物质的量(mol)分别为B
A、0.50、0.50、0.50 B、0.25、1.0、1.5 C、0.50、1.0、1.5 D、1.0、0.25、0.17
11、已知2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O;NO + NO2 + 2 NaOH = 2 NaNO2 + H2O。将224mL(标准状况)NO和NO2的混合气体溶于20 mL NaOH溶液中,恰好完全反应并无气体逸出,则NaOH溶液的物质的量浓度为B
A、1mol/L B、0.5 mol/L C、0.25 mol/L D、0.2 mol/L
12、将一定质量的镁铝合金投入到250ml 4mol/L的盐酸中,金属完全溶解后,再加入2mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种氢氧化钠溶液的体积是C
A、250ml B、400ml C、500ml D、750ml
13、在铁和氧化铁混合物15 g 中,加入稀硫酸150 mL,能放出H2 1.68 L(S、P、T)。同时铁
3+2+和氧化铁均无剩余,在所得溶液中没有Fe。为了中和过量的H2SO4,且使Fe完全转化成Fe(OH)2,
共消耗3 mol/L的NaOH溶液200 mL ,则原硫酸的物质的量浓度是B
A.1.5mol/L B.2mol/L C.2.5mol/L D.3mol/L
14、向一定量的FeO、Fe、Fe2O3的混合物中加入100ml1mol/L的盐酸,恰好使混合物完全溶解,
3+放出224ml标况下的气体,在所得溶液中没有Fe。若用足量CO在高温下还原同质量的此混
合物,能得到铁的质量是C
A、11.2g B、5.6g C、2.8g D、无法计算
15、向碘化钾溶液中加入硝酸银溶液,直到沉淀完全为止。已知反应后生成硝酸盐溶液质量恰好等于反应前原碘化钾溶液的质量。则加入硝酸银溶液的质量分数为C
A、69% B、75% C、72.5% D、48.3%
2--116、将K2SO4、Al2(SO4)3、KAl(SO4)2三种盐混合溶于极稀H2SO4溶液中,测得C(SO4)=0.105mol·L,
3+-1+-1+C(Al)=0.055mol·L,C(H)=0.010mol·L,则C(K)为B
-1-1-1-1A、0.045mol·L B、0.035mol·L C、0.055mol·L D、0.040mol·L
3+2-17、在K2SO4、Al2(SO4)3、的混合液中,已知c(Al)=0.4mol/L,c(SO4)=0.7mol/L,则溶液中
c(K+)为( )C
(A)0.1mol/L (B)0.15mol/L (C)0.2mol/L (D)0.25mol/L
18.某无水混合物由FeSO4和Fe2(SO4)3组成。测知该混合物中硫的质量分数为a%,则其中铁元素的质量分数为D
A.1-4a% B.1-2a% C.1-a% D.1-3a%
2-19.某地酸雨经检验,除H+ 和OH外,还有Na+、Cl?、NH+4、SO4,其物质的量浓度依次-
?52-为:c?Na+?=7.0×10?6 mol / L、c?Cl??=3.5×10?5 mol / L、c?NH+4?=2.3×10 mol / L、c?SO4?
=2.5×10?6 mol / L。则酸雨的c?H+?=________________。(1×10?5 mol / L)
范文二:平均摩尔质量
M的求法: ①摩尔质量数值上等于平均相对分子质量
②依据ρ=m/v=M/V→标况下M=22.4ρ
③依据同温同压下ρ1/ρ2=M1/M2=D(相对密度) ④依据定义式:M=m总/n总=(m1+m2+m3+…)/(n1+n2+n3+…)
⑤已知一个某分子的质量为ag,则该分子的摩尔质量为 .
练习:1.已知某混合气体在标况下的密度为ag/L,则该混合气体的平均相对分子质量为 已知:CH4和H2的混合气体在标况下的密度为25/56g/L 求①M= .②V(CH4): V(H2.
③甲烷中H原子个数与H2中H原子个数之比 .
④甲烷中原子个数与H2中原子个数之比 .
⑤甲烷中的电子数与H2中的电子数之比 .
⑥甲烷的质量与H2的质量之比 .
2.某混合气体的密度是相同条件下的H2密度的X倍,则该混合气体的M= . 已知:CH4和O2的混合气体是同条件下H2密度的14倍,则M= 。
另求:①V(CH4):V(O2 ②m(CH4):m(O2③ CH4的原子个数与O2的原子个数之比为
④ CH4的电子个数与O2的电子个数之比为
3.已知某分子的摩尔质量为M,则1个该分子的质量为. 1个氧气分子的质量xg,则O2的摩尔质量为 .
4.已知某混合气体的总质量m,为总物质的量为n,则M=m/n
⑴已知标准状况下5.6L CH4和O2的总质量为6g,则①M=
② V(CH4):V(O2 ③ m(CH4):m(O2
⑵求体积比为1:3的CH4和O2的M=
范文三:平均摩尔质量
200摄氏度时11.6g二氧化碳和水蒸气的混和气体与足量的过氧化钠充分反应后,固体增加了3.6g,则
= Xg, mHO = Yg 22原混和气体平均摩尔质量为( ) ? 2CO + 2NaO == 2NaCO + O ?m 222232A5.8g/mol B11.6g/mol C23.2g/mol D46.4g/mol 88 32 88 – 32 = 56 解答:设原混合气体中mCO
56 X ? X88
2HO + 2NaO == 4NaOH + O 36 – 32 = 4 2222
36 32
4Y ? Y36
? X,Y满足下列条件
X + Y = 11.6 解得: X = 4.4g ,
564 X,Y,3.6 Y = 7.2g 8836
原混合气体的平均摩尔质量:
m总11.6g M,,,23.2g/mol 4.47.2n总(,)mol4418
故选C.
范文四:平均摩尔质量
1 将0.5 molO2 和0.1molO3 混合,则混合气体的平均摩尔质量为________ 2 将20g NaOH与53 g Na2CO3 g混合,其物质的量为_______, 混合物的总质量为
_______, 该混合物的平均摩尔质量是
________。若有0.2 mol
该混合物的质量是_______ 3 氮气和氧气的混合气体的分子数为0.25NA,混合气体的总质量为7.5g,求混合气体的平均摩尔质量 4 已知CO和CO2混合气体的平均摩尔质量为40g/mol,则CO和CO2的物质的量之比是
_______。则CO和CO2的质量比为
_______________
5 现在有N2和H2混
合气体的质量为10g,
N2的分子数为0.3NA ,H2的分子数为0.2NA ,则混合气体的平均相
对分子质量是
6 现在有C02和C0混合气体,其分子数之
比1:3,则混合气体的平均摩尔质量是
7 现在有C02和C0混合气体,其平均摩尔质量是40 g/ mol,则C02与C0的分子数之比是
8 在合成氨的混合气体中,N2 和 H2的物质的量分数分别为75%和25%,则混合气体的
平均摩尔质量是
__________;分子数之比为:
__________________;0.5 mol 的混合气体的质量是_______
氮气、二氧化碳以物质的量比2:3混合,求混合气体的平均摩尔质量。
1. 二氧化碳、氢气、氯
气按体积比1:2:3混
合,求混合气体的平
均摩尔质量。
2. 已知氯化铵受热可
分解为氨气和氯化
氢,求其完全分解后
所得气体的平均相对
分子质量。
3. 氮气与氧气的平均
摩尔质量为32g/mol,
求两种气体的体积比(相同条件)。 4. 氮气与氧气混合气体的密度是相同条件下氢气密度的15.5倍,求两种气体的体积比(相同条件)。 5. 氧气与甲烷混合气体在标准状况下的密度为1.25g/L,求两种气体的质量比。
6. 氧气、甲烷和氮气混
合气密度与相同条件
下一氧化碳密度相
等,求三种气体的物
质的量比。
1、氧气与甲烷混合气体在标况下的密度为1.25g/L,求两种气体的质量比
2、在标准状况下氢气和一氧化碳的混合气体7L,质量为2.25g,求氢气和一氧化碳的质量分数和体积分数 在150 ?时碳酸铵可以受热完全分解,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的( )
练习;1、由CO 和CO 2组成的混合气体,其相对氢气的密度是18 ,则此混合气体中,CO和
CO 的体积比(同温同2
压下)为 ( )
A. 1:1 B. 1:2 C.
1:3 D. 2:1 2、由氨气、甲烷、氢
气三种气体组成的混
合气体的平均相对分
子质量为10,则NH、3
CH、H的体积比为 42
( )
A. 3:2:1 B. 1:2:3
C. 1:3:4 D. 2:3:4
3、由CH和CO组成4
的混合气体,在标准状
况下的密度为1 g/L,
则混合气体中CH和4
CO的质量比约为 ( )
A. 1?1 B. 1?2 C. 2?3 D. 7?8
4、实验测得乙烯(CH)24
与氧气混和气体的密
度是氢气14.5倍,可知
其中乙烯的质量百分
比为A. 25.0% B.
27.6% C. 72.4% D.
75.0%
5、由CO、H和CO22
组成的混合气体在同
温同压下与N的密度2
相同,则该混合气体中
CO、H和CO的体积22
比可能是 ( )
A. 29?8?13 B.
13?8?29 C. 26?16?39 D. 22?1?14
6、某固体A在一定条件下加热分解,产物全是气体。A分解反应为:2 A = B? + 2 C? + 2D?,现测得分解产生的混合气体对氢气的相对密度为d,则A的相对分子质量为 ( )
A. 2d B. 2.5d C.
5d D. 0.8d
7、N占空气总体积的2
a%,占空气总质量的b,,则空气的平均相对分子质量为 ( )
A. 28b/a B. 29a/b
C. ab/28 D. 28a/b 8、体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此气体倒扣在水中,进入容器中液体的体积是( ) (A)0.25L (B)0.5L (C)0.75L (D)1L
1.将标准状况下的
2mlO2与8mlN2混合,求混合气体的平均相对分子质量。
2.在标准状况下,
11.2LCO和CO2混合气体的质量为20.4g,求混合气体中CO和CO2的气体比和质量比。
3.在标准状况下,
10gCO和CO2组成的混合气体的体积为
6.72L,则此混合气体中CO和CO2的分子个数之比为多少,
4.由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则混合气体中CO2、H2和CO的体积比为( )
A.29:8:13
B.22:1:14
C.13:8:29
D.26:16:57 1、氮气与二氧化碳以体积比2:3混合,求混合气体的平均摩尔质量
3、氧气与氮气混合气体的密度为相同条件下氢气的15.5倍,求两种气体的体积比(相同
条件)
1
2
3
2
2
2
范文五:摩尔体积和平均摩尔质量
《与平均摩尔质量有关的计算》
【相关知识】
1. 平均摩尔质量的概念(公式1):M=m(总)/n(总),平均摩尔质量在以g/mol为单位时,数值上等于混合物平均相对分子质量
2. 平均摩尔质量的另一计算(公式2)
3. 十字交叉法
【例1】氮气、二氧化碳以物质的量比2:3混合,求混合气体的平均摩尔质量。 可以利用公式1计算,用十字交叉法验证
【例2】氮气、二氧化碳以体积比2:3(相同条件)混合,求混合气体的平均摩尔质量。 可以利用公式2计算,用十字交叉法验证
【练习】
1. 二氧化碳、氢气、氯气按体积比1:2:3混合,求混合气体的平均摩尔质量。
2. 已知氯化铵受热可分解为氨气和氯化氢,求其完全分解后所得气体的平均相对分子质量。
3. 氮气与氧气的平均摩尔质量为32g/mol,求两种气体的体积比(相同条件)。
4. 氮气与氧气混合气体的密度是相同条件下氢气密度的15.5倍,求两种气体的体积比(相同条件)。
5. 氧气与甲烷混合气体在标准状况下的密度为1.25g/L,求两种气体的质量比。
6. 氧气、甲烷和氮气混合气密度与相同条件下一氧化碳密度相等,求三种气体的物质的量比。
1.将 40gNaOH 溶于水,配成 250mL 溶液 A,A 的物质的量浓度为___________。 将 50mLA 加水稀释至 100mL 后,得溶液 B,B 的物质的量浓度为__________。将 10mLB 溶液与密度为 1.11g/cm 9%的 NaOH 洗
涤剂 10mL 混合,该混合溶液 C 的 物质的量浓度为__________。
2.配制 0.1mol/L 盐酸溶液 500mL,请按操作顺序[⑴、⑵、⑶……]填写在操作前 的括号内,并在横线上填写适当的仪器名称,操作方法或数字。 ( )在盛盐酸的烧杯中注入蒸馏水(溶液体积少于 500mL),用玻璃棒搅拌,使其混匀。 ( )待稀释的盐酸冷却后,沿玻璃棒注入 500mL 的容量瓶中。 ( )用量筒量取密度为1.19g/cm3 质量分数为 37%的浓盐酸约(取整数) ( )用蒸馏水洗涤烧杯 2~3 次,将洗涤液注入容量瓶中。 ( )往容量瓶中小心加蒸馏水至液面接近刻度________cm 处,改用________加蒸馏 水,使溶液__________恰好与刻度线相切。
3.配制 100mL0.20mol/LKCl 溶液时,某学生将准确称量的 1.49gKCl 固体放入烧杯中,加入约 30mL 蒸馏水,用玻璃棒搅拌使其溶解。将溶液由烧杯倒入 100mL 容量瓶中,然后往容量瓶中小 心地加入蒸馏水,直至液面接近刻度 2cm~3cm 处。改用胶头滴管加蒸馏水,使溶液凹面最低点 恰好与刻度相切。把容量瓶盖紧,再振荡摇匀。该生操作中的错误是_____________、 ________________________________。
4.常温下,相对分子质量为 M 的某无水盐 A 的溶解度为 Sg,则常温时,该盐饱 和溶液的质量分数为__________,如果已知该饱和溶液的密度为ρg/cm3,则该溶液 的物质的量浓度为___________。 50.普通酒精中乙醇的含量为 96%,15°C 时密度为 0.76g/cm3,将乙醇看作溶剂,水看作溶质, 普通酒精中水的物质的量浓度是________________。
5.将 MgCl2·xH2O 的晶体 4.06g 溶于水配成 100mL 溶液,此溶液 50mL 正好与 50mL0.4mol/L 的 AgNO3 溶液完全作用。由上述数据可知 4.06g
的 MgCl2·xH2O 是 _______mol,式中 x 的数值是_____。
6.往某 BaCl2 溶液中加入密度为 1.28g/mL 的硫酸溶液,恰好完全反应后,过滤,测得滤液的质量与对 BaCl2 溶液的质量相等。则所加硫酸溶液的物质的量浓度是____________。
三、计算题
7.常温下,将 150mL 22% NaNO3 溶液加 100g 蒸馏水后,溶液中溶质的质量分数变为 14%。求原 溶液的物质的量浓度。
8.向 50mLNa2SO4 和 Na2CO3 的混合溶液中加入过量的 BaCl2 溶液,得到 14.51g 白 色沉淀,向白色沉淀中加入过量的稀 HNO3,充分反应后,沉淀减少到 4.66g,并有气体产生。
⑴原混合溶液中 Na2SO4 和 Na2CO3 的物质的量浓度各是多少? ⑵产生的气体在标准状况下的体积是多少?



 马桶污污污
马桶污污污

