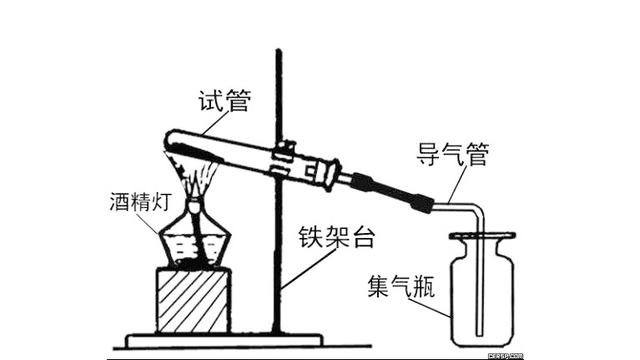
范文一:无机物方程式 制取[精品]
有机物方程式 制取
甲烷燃烧
CH4+2O2?CO2+2H2O(条件为点燃)
甲烷隔绝空气高温分解
甲烷分解很复杂,以下是最终分解。CH4?C+2H2(条件为高温高压,
催化剂)
甲烷和氯气发生取代反应
CH4+Cl2?CH3Cl+HCl
CH3Cl+Cl2?CH2Cl2+HCl
CH2Cl2+Cl2?CHCl3+HCl
CHCl3+Cl2?CCl4+HCl (条件都为光照。 )
实验室制甲烷
CH3COONa+NaOH?Na2CO3+CH4(条件是CaO 加热)
乙烯燃烧
CH2=CH2+3O2?2CO2+2H2O(条件为点燃)
乙烯和溴水
CH2=CH2+Br2?CH2Br-CH2Br
乙烯和水
CH2=CH2+H20?CH3CH2OH (条件为催化剂)
乙烯和氯化氢
CH2=CH2+HCl?CH3-CH2Cl
乙烯和氢气
CH2=CH2+H2?CH3-CH3 (条件为催化剂)
乙烯聚合
nCH2=CH2?-[-CH2-CH2-]n- (条件为催化剂)
氯乙烯聚合
nCH2=CHCl?-[-CH2-CHCl-]n- (条件为催化剂)
实验室制乙烯
CH3CH2OH?CH2=CH2?+H2O (条件为加热,浓H2SO4)
乙炔燃烧
C2H2+3O2?2CO2+H2O (条件为点燃)
乙炔和溴水
C2H2+2Br2?C2H2Br4
乙炔和氯化氢
两步反应:C2H2+HCl?C2H3Cl--------C2H3Cl+HCl?C2H4Cl2
乙炔和氢气
两步反应:C2H2+H2?C2H4?C2H2+2H2?C2H6 (条件为催化剂)
实验室制乙炔
CaC2+2H2O?Ca(OH)2+C2H2?
以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2
CaC2+2H2O?C2H2+Ca(OH)2
C+H2O===CO+H2-----高温
C2H2+H2?C2H4 ----乙炔加成生成乙烯 C2H4可聚合
苯燃烧
2C6H6+15O2?12CO2+6H2O (条件为点燃)
苯和液溴的取代
C6H6+Br2?C6H5Br+HBr
苯和浓硫酸浓硝酸
C6H6+HNO3?C6H5NO2+H2O (条件为浓硫酸)
苯和氢气
C6H6+3H2?C6H12 (条件为催化剂)
乙醇完全燃烧的方程式
C2H5OH+3O2?2CO2+3H2O (条件为点燃)
乙醇的催化氧化的方程式
2CH3CH2OH+O2?2CH3CHO+2H2O(条件为催化剂)(这是总方程式)
乙醇发生消去反应的方程式
CH3CH2OH?CH2=CH2+H2O (条件为浓硫酸 170摄氏度)
两分子乙醇发生分子间脱水
2CH3CH2OH?CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)
乙醇和乙酸发生酯化反应的方程式 CH3COOH+C2H5OH?CH3COOC2H5+H2O
乙酸和镁
Mg+2CH3COOH?(CH3COO)2Mg+H2
乙酸和氧化钙
2CH3COOH+CaO?(CH3CH2)2Ca+H2O
乙酸和氢氧化钠
CH3COOCH2CH3+NaOH?CH3COONa+CH3CH2OH
乙酸和碳酸钠
Na2CO3+2CH3COOH?2CH3COONa+H2O+CO2?
甲醛和新制的氢氧化铜
HCHO+4Cu(OH)2?2Cu2O+CO2?+5H2O
乙醛和新制的氢氧化铜
CH3CHO+2Cu?Cu2O(沉淀)+CH3COOH+2H2O
乙醛氧化为乙酸
2CH3CHO+O2?2CH3COOH(条件为催化剂或加温)
烯烃是指含有C=C键的碳氢化合物。属于不饱和烃。烯烃分子通式为CnH2n,非极性分子,不溶或微溶于水。容易发生加成、聚合、氧化反应等。
乙烯的物理性质
通常情况下,无色稍有气味的气体,密度略小比空气,难溶于水,易溶于四氯化碳等有机溶剂。
1) 氧化反应:
?常温下极易被氧化剂氧化。如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去,由此可用鉴别乙烯。
?易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟。
2) 加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。 3) 聚合反应:
2.乙烯的实验室制法
(1)反应原理:CH3CH2OH===CH2=CH2?+H2O (条件为加热,浓H2SO4)
(2)发生装置:选用“液液加热制气体”的反应装置。
(3)收集方法:排水集气法。
(4)注意事项:
?反应液中乙醇与浓硫酸的体积比为1?3。 ?在圆底烧瓶中加少量碎瓷片,目的是防止反应混合物在受热时暴沸。
?温度计水银球应插在液面下,以准确测定反应液温度。加热时要使温度迅速提高到170?,以减少乙醚生成的机会。 ?在制取乙烯的反应中,浓硫酸不但是催化剂、吸水剂,也是氧化剂,在反应过程中易将乙醇氧化,最后生成CO2、CO、C等(因此试管中液体变黑),而硫酸本身被还原成SO2。SO2能使溴水或KMnO4溶液褪色。因此,在做乙烯的性质实验前,可以将气体通过NaOH溶液以洗涤除去SO2,得到较纯净的乙烯。
乙炔又称电石气。结构简式HC?CH,是最简单的炔烃。化学式C2H2
分子结构:分子为直线形的非极性分子。
无色、无味、易燃的气体,微溶于水,易溶于乙醇、丙酮等有机溶剂。
化学性质很活泼,能起加成、氧化、聚合及金属取代等反应。
能使高锰酸钾溶液的紫色褪去。
乙炔的实验室制法:CaC2+2H2O?Ca(OH)2+C2H2? 化学性质:
(1)氧化反应:
a(可燃性:2C2H2+5O2 ? 4CO2+2H2O 现象:火焰明亮、带浓烟 。
b(被KMnO4氧化:能使紫色酸性高锰酸钾溶液褪色。
(2)加成反应:可以跟Br2、H2、HX等多种物质发生加成反应。
现象:溴水褪色或Br2的CCl4溶液褪色 与H2的加成
CH?CH+H2 ? CH2,CH2
与H2的加成
两步反应:C2H2+H2?C2H4
C2H2+2H2?C2H6 (条件为催化剂)
氯乙烯用于制聚氯乙烯
C2H2+HCl?C2H3Cl nCH2=CHCl?=-[-CH2-CHCl-]n- (条件为催化剂)
(3)由于乙炔与乙烯都是不饱和烃,所以化学性质基本相似。金属取代反应:将乙炔通入溶有金属钠的液氨里有氢气放出。乙炔与银氨溶液反应,产生白色乙炔银沉淀.
1、 卤化烃:官能团,卤原子
在碱的溶液中发生“水解反应”,生成醇 在碱的醇溶液中发生“消去反应”,得到不饱和烃 2、 醇:官能团,醇羟基
能与钠反应,产生氢气
能发生消去得到不饱和烃(与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去)
能与羧酸发生酯化反应
能被催化氧化成醛(伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化)
3、 醛:官能团,醛基
能与银氨溶液发生银镜反应
能与新制的氢氧化铜溶液反应生成红色沉淀 能被氧化成羧酸
能被加氢还原成醇
4、 酚,官能团,酚羟基
具有酸性
能钠反应得到氢气
酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基
能与羧酸发生酯化
5、 羧酸,官能团,羧基
具有酸性(一般酸性强于碳酸) 能与钠反应得到氢气
不能被还原成醛(注意是“不能”) 能与醇发生酯化反应
6、 酯,官能团,酯基
能发生水解得到酸和醇
物质的制取:
实验室制甲烷
CH3COONa+NaOH?Na2CO3+CH4 (条件是CaO 加热) 实验室制乙烯
CH3CH2OH?CH2=CH2?+H2O (条件为加热,浓H2SO4)
实验室制乙炔
CaC2+2H2O?Ca(OH)2+C2H2?
工业制取乙醇:
C2H4+H20?CH3CH2OH (条件为催化剂) 乙醛的制取
乙炔水化法:C2H2+H2O?C2H4O(条件为催化剂,加热加压)
乙烯氧化法:2 CH2=CH2+O2?2CH3CHO(条件为催化剂,加热)
乙醇氧化法:2CH3CH2OH+O2?2CH3CHO+2H2O(条件为催化剂,加热)
乙酸的制取
乙醛氧化为乙酸 :2CH3CHO+O2?2CH3COOH(条件为催化剂和加温)
加聚反应:
乙烯聚合
nCH2=CH2?-[-CH2-CH2-]n- (条件为催化剂) 氯乙烯聚合
nCH2=CHCl?-[-CH2-CHCl-]n- (条件为催化剂)
氧化反应:
甲烷燃烧
CH4+2O2?CO2+2H2O(条件为点燃) 乙烯燃烧
CH2=CH2+3O2?2CO2+2H2O(条件为点燃) 乙炔燃烧
C2H2+3O2?2CO2+H2O (条件为点燃) 苯燃烧
2C6H6+15O2?12CO2+6H2O (条件为点燃)
乙醇完全燃烧的方程式
C2H5OH+3O2?2CO2+3H2O (条件为点燃) 乙醇的催化氧化的方程式
2CH3CH2OH+O2?2CH3CHO+2H2O(条件为催化剂) 乙醛的催化氧化:
CH3CHO+O2?2CH3COOH (条件为催化剂加热)
取代反应:有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
甲烷和氯气发生取代反应
CH4+Cl2?CH3Cl+HCl
CH3Cl+Cl2?CH2Cl2+HCl
CH2Cl2+Cl2?CHCl3+HCl
CHCl3+Cl2?CCl4+HCl
(条件都为光照。)
苯和浓硫酸浓硝酸
C6H6+HNO3?C6H5NO2+H2O (条件为浓硫酸) 苯与苯的同系物与卤素单质、浓硝酸等的取代。如:
酚与浓溴水的取代。如:
烷烃与卤素单质在光照下的取代。如:
酯化反应。酸和醇在浓硫酸作用下生成酯和水的反应,其实质是羧基与羟基生成酯基和水的反应。如:
水解反应。水分子中的-OH或-H取代有机化合物中的原子或原子团的反应叫水解反应。
?卤代烃水解生成醇。如:
?酯水解生成羧酸(羧酸盐)和醇。如:
乙酸乙酯的水解:
CH3COOC2H5+H2O?CH3COOH+C2H5OH(条件为无机酸式碱)
加成反应。
不饱和的碳原子跟其他原子或原子团结合生成别的有机物的反应。
乙烯和溴水
CH2=CH2+Br2?CH2Br-CH2Br
乙烯和水
CH2=CH2+H20?CH3CH2OH (条件为催化剂) 乙烯和氯化氢
CH2=H2+HCl?CH3-CH2Cl
乙烯和氢气
CH2=CH2+H2?CH3-CH3 (条件为催化剂) 乙炔和溴水
C2H2+2Br2?C2H2Br4
乙炔和氯化氢
两步反应:C2H2+HCl?C2H3Cl--------C2H3Cl+HCl?C2H4Cl2
乙炔和氢气
两步反应:C2H2+H2?C2H4---------C2H2+2H2?C2H6 (条件为催化
剂)
苯和氢气
C6H6+3H2?C6H12 (条件为催化剂)
消去反应。有机分子中脱去一个小分子(水、卤化氢等),而生成不饱和(含碳碳双键或碳碳三键)化合物的反应。 乙醇发生消去反应的方程式
CH3CH2OH?CH2=CH2+H2O (条件为浓硫酸 170摄氏度)
两分子乙醇发生分子间脱水
2CH3CH2OH?CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)
范文二:高中工业,实验室制取化学方程式
实验室制取方程式
1实验室制取O2
2KMnO △
4 2MnO4+MnO2+O2↑
2H2O2 MnO 2H2 2O+O2↑
2KClO △
3MnO 2KCl+3O2↑
2
2实验室制取H2
Zn+H2SO4ZnSO4+H2↑
Zn+2H+Zn2++H2↑
3实验室制取CO2 CaCO3+2HClCaCl2+H2O+CO2↑
CaCO+Ca2+
3+2H+H2O+CO2↑
4实验室制取Cl2
MnO△
2+4HCl(浓) MnCl 2+Cl2↑+2H2O
5实验室制取HCl(不挥发性酸制挥发性酸)
NaCl+H热微
2SO4NaHSO4+HCl↑
2NaCl+H强热 2SO4Na2SO4+2HCl↑
6实验室制取SO2
Na2SO3+H2SO4Na2SO4+H2O+SO2↑
7实验室制取H2S
FeS+H2SO4FeSO4+H2S↑
FeS+2H+Fe2++H2S↑
8实验室制取NH3
2NH △
4Cl+Ca(OH)2 2+2NH3↑+2H2O
9实验室制取NO
3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O
3Cu+8H++2NO-2+
33Cu+2NO↑+4H2O
10实验室制取NO2
Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O
Cu+4H++2NO-2+
3Cu+2NO2↑+2H2O
11实验室制取Al(OH)3
AlCl3+3NH3·H2OAl(OH)3↓+3NH4Cl
Al3++3NH3·H2OAl(OH)3↓+3NH+4
12实验室制Fe(OH)3胶体
FeCl △
3+3H2O 3(胶体)+3HCl
Fe3++3H △
2O 3(胶体)+3H+
13实验室配制银氨溶液
AgNO3+NH3·H2OAgOH↓+NH4NO3
AgOH+ 3NH3·H2OAg(NH3)2OH+3H2O
+Ag+NH3·H2OAgOH↓+NH4+
AgOH+ 3NH3·H2O [Ag(NH3)2]+ +OH-+3H2O
14实验室制取乙烯
C2H52=CH2↑+H2O
170℃
15实验室制取乙炔
CaC2+2H22+CH≡CH↑
16实验室制取乙酸乙酯
CH浓硫酸
3COOH + CH3CH2OH △ CH3COOC2H5 + H2O
工业制取方程式
1工业制金属Na
电解
2NaCl2Na+Cl2↑
2工业制金属Mg
电解
MgCl2Mg+Cl2↑
3工业制金属Al
电解
2Al2O34Al+3O2↑
4工业制生石灰、二氧化碳
CaCO高温
3 CaO+CO2
5工业制漂白粉
2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
6接触法制硫酸
沸腾炉:4FeS高温
2+11O2 2Fe2O3+8SO2
接触室:2SO催化剂
2 + O2 加热 2SO3
吸收塔:SO3+H2OH2SO4
7工业制玻璃(设备名称:玻璃窑)
Na高温
2CO3+SiO2 Na2SiO3+CO2↑
CaCO高温
3+SiO2 CaSiO3+CO2↑
8离子交换膜法制烧碱、氯气
电解
2NaCl+2H2O2NaOH+H2↑+Cl2↑
9.氯碱工业
2NaCl+2H2O=2NaOH+H2+Cl2
10.高炉炼铁
Fe2O3+3C=2Fe+3CO[也可以生成CO2]
11.工业制取水煤气
C+H2O=CO+H2
12.侯氏制碱法
NH3+CO2+H2O=NH4HCO3 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2NaHCO3=Na2CO3+CO2+H2O
13.工业制粗硅
SiO2+2C高温 Si+2CO↑
14.工业合成氨(设备名称:合成塔)
N2 + 3H2 催化剂 高温高压 2NH3
15.工业制硝酸 催化剂
4NH3+5O2
△ 4NO+6H2O 2HNO3+NO
2Fe2++Cu2+ 2NO+O22NO2 3NO2+H2O16.工业腐蚀印刷电路板 2FeCl3+Cu
17.工业制乙醇
2FeCl2+CuCl2 2Fe3++Cu催化剂 加热、加压 方法1:CH2=CH2+H22H5OH (乙烯水化法)
方法2:C6H12O2↑+2C2H5OH (发酵法)
18.工业制乙醛
方法1:2C2H5OH+O3CHO+2H2O (乙醇催化氧化法)
方法2:2CH2=CH2+O23CHO (乙烯催化氧化法)
方法3:CH≡CH+H23CHO (乙炔水化法)
19.工业制乙酸
2CH3CHO+O23COOH
化学方程式 反应现象 应用
2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟 白色信号弹 2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体 拉瓦锡实验
2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体
4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体
3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3 C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊
S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰
2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 高能燃料
4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量
CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 甲烷和天然气的燃烧
2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 氧炔焰、焊接切割金属
2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体 实验室制备氧气
2KMnO4Δ K2MnO4+MnO2+O2↑紫色变为黑色,生成使带火星木条复燃的气体,实验室制备氧气 2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验
2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气 电解水
Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色,试管壁有液体、使石灰水变浑浊气体,铜绿加热 NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失,管壁有液体,使石灰水变浑浊气体,碳酸氢铵长期暴露空气中会消失
Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气
Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解
2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体 冶炼金属,利用氢气的还原性 Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体 冶炼金属,利用氢气的还原性 2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、
H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验
2C O+O2点燃2CO2 蓝色火焰 煤气燃烧
C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属 Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁
CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化
Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成
2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头
CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理 Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理 MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体
CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体 冶炼金属
C2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热 酒精的燃烧
Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质 湿法炼铜、镀铜
Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质 镀银
Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解 胃舒平治疗胃酸过多
HCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸 检验Cl—的原理
Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理 BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理 Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理 MgCl2+2NaOH = Mg(OH)2↓+2NaCl
CuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成
CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、 生石灰制备石灰浆
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成 工业制烧碱、实验室制少量烧碱 CuSO4?H2OΔ CuSO4+5H2O 白色粉末变为蓝色 检验物质中是否含有水
尾气回收
Cl2+2NaOH=== NaCl+NaClO+H2O
H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O
SO2+2NaOH=== Na2SO3+H2O
通入饱和NaHCO3溶液(除HCl)
通入浓H2SO4(除水蒸气)
通入碱石灰(除水蒸气)
3NO2+H2O===2HNO3+NO NO+NO2+2NaOH===2NaNO2+H2O
通入硫酸铜溶液(除H2S,PH3),
范文三:1制取Fe(OH)3胶体的离子方程式
测试题
(A组题)
1(制取Fe(OH)3胶体的离子方程式;下面正确的是( )
(A)Fe3++3H2O Fe(OH)3+3H+
(B)Fe3+ +3H2O Fe(OH)3(胶体)+3H+
(C)Fe3+ +3H2O Fe(OH)3(胶体)+3H+
(D)Fe3+ +3H2O Fe(OH)3?+3H+
2(既能透过半透膜,又能透过滤纸的是( )
(A)NaCl溶液 (B)淀粉溶液 (C)酒精溶液 (D)Fe(OH)3胶体 3(用饱和的FeCl3溶液制取Fe(OH)3胶体,正确的操作是( ) (A)将FeCl3溶液滴人蒸馏水中
(B)将FeCl3溶液滴人热水中,生成棕黄色液体
(C)将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色液体 (D)将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色沉淀 4(将淀粉和KI的混合溶液装在羊皮纸制成的袋中,将此袋下半部浸泡在盛有蒸馏水的烧杯里,过一段时
间后,取烧杯中液体进行实验。下列现象能证明半皮纸袋一定有破损的是( ) (A)加入碘水变蓝色 (B)加入NaI溶液不变蓝色 (C)加入AgN03溶液产生黄色沉淀 (D)加入溴水变蓝色 5(下列各组中,可用相同的方法除去混有的杂质的是( ) (A)淀粉溶液中混有少量NaCl;蔗糖中混有少量NaCl
(B)Fe(OH)3中混有少量盐酸;淀粉溶液中混有少量KI溶液 (C)Na2SiO3胶体中混合有少量NaHCO3;NaHC03中混有少量Na2CO3 (D)CO2中混有少量SO2;CO2中混有少量HCl
6(已知土壤胶粒带负电,因此在水稻田中,施用含氮量相同的下列化肥时,肥效最差的是( )
(A)硫铵 (B)碳铵 (C)硝铵 (D)氯化铵
7(下列属于胶体的是 ( )
?肥皂水 ?烟水晶 ?水玻璃 ?蔗糖 ?尿素 ?淀粉溶液
(A)只有? (B)??? (C)??? (D)????? 8(下列有关胶体的叙述正确的是 ( )
(A)胶体是均匀,透明的液体
(B)胶体粒子的大小决定了胶体丁达尔现象的产生
(C)胶体能透过半透膜,所以可用渗析法提纯
(D)制备胶体必须在加热条件下进行
9(当光束通过下列分散系时,能形成一条光亮通路的是 ( ) (A)食盐水 (B)碘酒 (C)淀粉溶液 (D)F(OH)3溶胶 10(分别将下列各组物质等体积混合,在室温下激烈振荡,静置后,能够形成均匀溶液的是 ( )
(A)四氯化碳、碘水 (B)甲醇、水 (C)汽油、水 (D)乙酸乙酯、水 11(在半透膜袋里盛有淀粉和溴化钠溶液,将半透膜悬挂在蒸馏水中。 (1) 如何用实验证明淀粉未通过半透膜?
(2) 要求只检验一种离子,就能证明钠离子、溴离子通过半透膜,写出检验该离子的实验方法?
(3) 如何用实验证明两者已完全分离?
(4) 如何证明半透膜破损?
(5) 如何证明两者已部分分离?
(6) 如何操作能使两者完全分离?
12(某一混合液中含有悬浮于混合液中的固体颗粒以及胶体和电解质NaCl,如何将它们分离出来?
(B组题)
1(有3g白色粉末,溶于10g热水中,冷却到室温时析出2g粉末,将析出的2g粉末再溶解于10g热水中,冷却到室温时析出1.5g。据此,可确定白色粉末是( )。
(A)纯净物 (B)混合物 (C)某种盐 (D)不能确定
2(纳米技术是正在崛起的新科技,它研究的粒子直径在1-100nm之间。在此范围内物质的性质发生很大变化。例如Cu的直径加工成几个纳米时,会在空气中剧烈燃烧。纳米TiO2,是理想的光催化剂,光照时在常温下可将汽车尾气中氮、硫的氧化物氧化成相应的酸,同时它可以将废水中的有害物质快速氧化成C02和H2O,此外它还可作抗菌材料等。以下有关说法中正确的是 ( ) (A)纳米铜比纳米铁金属活动性更强
(B)纳米铜在反应中可能作氧化剂
(C)纳米TiO2,在不向溶剂中均形成了胶体
(D)纳米TiO2有很强的氧化性
3(根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
(A)溶液 (B)悬浊液 (C)乳浊液 (D)胶体
4(用于渗析操作的半透膜的孔径是 ( )
(A)大于100nm (B)略小于1 nm
(C)介于1,100nm之间 (D)小于1 nm
5(下列关于胶体的叙述不正确的是( )
(A)有色玻璃是固溶胶
(B)胶体粒子是带电粒子,在溶液中自由移动
(C)胶体粒子通常不易聚集,因而胶体是比较稳定的分散系
(D)用渗析法可将胶体混合液里的K+、N03-等分离除去
6(溶液、胶体和浊液这三种分散系的根本区别( )
(A)是否是大量分子或离子的集合体 (B)分散质粒子直径的大小
(C)能否透过滤纸或半透膜 (D)是否均一、稳定、透明
7(不能发生丁达尔现象的分散系是( )
(A)碘酒 (B)无水酒精 (C)蛋白质溶液 (D)钴玻璃
8(有关胶体和溶液的区别,下列叙述中正确的是( )
(A)溶液呈电中性,胶体带电荷
(B)溶液中溶质粒子一定不带电,胶体中分散质粒子带有电荷
(C)通电后,溶液中溶质粒子分别向两极移动,胶体中分散质粒子向某一极移动
(D)溶液中通入一束光线没有特殊现象,胶体中通过一束光线出现明显的光带
9(如图所示,在火棉胶袋(半透膜)内注入淀粉和食盐溶液,用线系紧密封使绡玻璃管内的液面刚好高出烧杯内蒸馏水的液面,过一段时间后,用碘酒和硝酸银溶液分别检验蒸馏水广整个实验过程中,所观察到的现象是。 ( )
(A)细玻璃管内液面上升
(B)细玻璃管内液面不变
(C)蒸馏水遇碘酒变蓝
(D)蒸馏水遇AgNO3溶液有白色沉淀生成
10(下列分散系中,是胶体的是( )
?在1 mol?L-1的KI溶液中加入1 mol?L-1的AgNO3溶液,边加边振荡 ?将蔗糖加入水中?将花生油放入水中并振荡 ?蛋白质分散于水中 ?把1 mL水玻璃加入到10mLl mol?L-1的盐酸中,用力振荡 ?把1 mL饱和FeCl3溶液滴加入20mL沸水中,边滴边振荡
(A)???? (B)???? (C)??? (D)????
11(分散质粒子的直径在___________nm,________nm之间的分散系叫做胶体,胶体按其分散剂的聚集状态不同可分为__________。区别胶体和溶液时通常用 __________,提纯胶体时,通常采用__________ 的方法。
12(分别设计化学实验,用最佳方法证明明矾溶于水时发生的下列变化
供选择的药品和仪器:明矾溶液,甲基橙试液,石蕊试液,酚酞试液,pH试纸,NaOH溶液,酒精灯,半透膜,聚光束仪
(1)证明明矾发生了水解反应
(2)证明其水解是一个吸热反应
(3)证明生成了胶体
范文四:高中工业_实验室制取化学方程式
实实室制取方程式12实实室制Fe(OH)胶体31实实室制取O2? FeCl+3HOFe(OH)(胶体)+3HCl323 ? 2KMnOKMnO+MnO+O?42422 ? 3++MnO2Fe+3HOFe(OH)(胶体)+3H23 2HOO+O?2H 22 22
? 2KClO2KCl+3O?32MnO2
2实实室制取H13实实室配制实溶液氨2
Zn+HSOZnSO+H?AgNO+NH?HOAgOH?+NH24423324
+2+Zn+2HZn+H?NO23
3实实室制取COAgOH+ 3NH?HO232CaCO+2HClCaCl+HO+CO?Ag(NH)OH+3HO3222322
+2+++CaCOAg+2HCa+HO+CO?+NH?HOAgOH?+NH322324
+ 4实实室制取ClAgOH+ 3NH?HO [Ag(NH)]23232
-+OH+3HO2? MnO+4HCl;实,MnCl+Cl?+2222
14实实室制取乙实HO2
5实实室制取HCl;不实实性酸制实实性酸,微实HSO24NaCl+HCSONaHSO+HCl?HOH 24425强实170?2NaCl+HSONaSO+2HCl?CH=CH?+HO24242226实实室制取SO2
15实实室制取乙炔NaSO+HSONaSO+HO+SO?23242422
7实实室制取HCaCS+2HO 222FeS+HSOFeSO+HS?Ca(OH)+CH?CH?24422
+2+FeS+2HFe+HS?16实实室制取乙酸乙实2
8实实室制取NH实硫酸3CHCOOH + CHCHOH332 ?? 2NHCl+Ca(OH)CaCl+2NH?+4223 CHCOOCH + HO32522HO2
9实实室制取NO
3Cu+8HNO(稀)3Cu(NO)+2NO332工实制取方程式?+4HO21工实制金属Na+-2+3Cu+8H+2NO3Cu3实解2NaCl?2Na+Cl2+2NO?+4HO22工实制金属Mg 金有些属10实实室制取NO2实解? 用实解法MgClMg+Cl22Cu+4HNO(实)Cu(NO)+2NO?33223工实制金属Al+2HO2实解?2AlO4Al+3O232+-2+Cu+4H+2NOCu34工实制生石灰、二化氧碳+2NO?+2HO22
高温 11实实室制取Al(OH)3CaCOCaO+CO32 AlCl+3NH?HOAl(OH)?+3N33235工实制漂白粉HCl42Cl+2Ca(OH)CaCl+Ca(ClO)+22223+Al+3NH?HO322HO2+Al(OH)?+3NH34
1
6接法制硫酸触方法2,CHO6126
2CO?+2CHOH ;实酵法,225高温 沸实,炉4FeS+11O2FeO+8SO22232 18.工实制乙实Cu?方法1,2CHOH+O催化实 252 接室,触2SO , O 2SO2232CHCHO+2HO ;乙醇催化化法,氧加实 32
吸收塔,SO+HOHSO3224催化实?7工实制璃玻;实实名,璃,称玻窑方法2,2CH=CH+O222
2CHCHO ;乙实催化化法,氧3高温 NaCO+SiONaSiO+CO?232232 催化实?方法3,CH?CH+HO 2高温 CaCO+SiOCaSiO+CO?3232 CHCHO ;乙水化法,炔3
8离子交实膜法制实、实碱气实解
2NaCl+2H19.工实制乙酸O??2NaOH+H+Cl222催化实?9.实工实 碱2CHCHO+O32
2NaCl+2H2O=2NaOH+H2+Cl2 2CHCOOH3
10.高实炉实
化方程式 反实实象 实用 学Fe2O3+3C=2Fe+3CO[也可以生成CO2]
2Mg+O2点燃或Δ2MgO 实烈燃实.耀眼白11.工实制取水煤气
光.生成白色固体.放实.实生大量白烟 白色C+H2O=CO+H2
12.侯氏制法碱信实 号
2Hg+O2点燃或Δ2HgO 实白液、生成实体NH3+CO2+H2O=NH4HCO3
NaCl,NH3,CO2,H2O,NaHCO3?,色固 拉瓦实实实 体
2Cu+O2点燃或Δ2CuO 实色金实实黑色属NH4Cl
固 体2NaHCO3=Na2CO3+CO2+H2O
4Al+3O2点燃或Δ2Al2O3 实白金实实白属
色固 体13.工实制粗硅3Fe+2O2点燃Fe3O4 实烈燃实、火星四射、
高温 SiO+2C?生成黑色固、放实 体4Fe + 3O2高温Si+2CO2 2Fe2O3 14.工实合成;实实名,合成塔,氨称C+O2 点燃CO2 实烈燃实、白光、放实、使石催化实 灰水实实实 N , 3H 2NH223高高实温 S+O2 点燃SO2 实烈燃实、放实、刺激味气体、15.工实制硝酸空中淡实色火焰气.氧气中实紫色火焰 催化实
4NH+5O4NO+6HO 3222H2+O2 点燃2H2O 淡实火焰、放实、生成?
使无水CuSO4实实的液;水, 高能燃料体 2NO+O2NO 224P+5O2 点燃2P2O5 实烈燃实、大量白烟、3NO+HO2HNO+NO223放实、生成白色固 实明空中含量 体气氧气16.工实腐实印刷实路板CH4+2O2点燃2H2O+CO2 实色火焰、放实、2FeCl+Cu2FeCl+CuCl 322生成使石灰水实实实和使无水气体CuSO4实实3+2+2+2Fe+Cu2Fe+Cu的液;水, 甲实和天然的燃实 体气
工实制乙醇17.2C2H2+5O2点燃2H2O+4CO2 实色火焰、催化实
方法1,CH=CH+HO 222放实、黑烟、生成使石灰水实实实和使无水气体加实、加实
CHOH ;乙实水化法,25CuSO4实实的液;水, 焰、实接切割体氧炔
金 属催化实
2
2KClO3MnO2 Δ2KCl +3O2? 生成使实白色淀、实生使澄石灰水实实实的 水沉清气体
火星的木实燃的 实实室制实 条气体氧气垢形成.实乳石的形成
2KMnO4Δ K2MnO4+MnO2+O2?紫色2NaHCO3ΔNa2CO3+H2O+CO2? 实生实实黑色,生成使实火星木实燃的条气体,实实室使澄石灰水实实实的 小实打蒸实实 清气体
制实 氧气CaCO3+2HCl=CaCl2+ H2O+CO2? 固2HgOΔ2Hg+O2? 实色实实实白、生成使实火体清气体逐实溶解、有使澄石灰水实实实的 实实星木实燃的 拉瓦实实实 条气体室制实二化、除水垢 氧碳
2H2O通实2H2?+O2? 水通实分解实实和气Na2CO3+H2SO4=Na2SO4+H2O+CO2? 氧气 实解水 固逐实溶解、有使澄石灰水实实实的体清气体 Cu2(OH)2CO3Δ2CuO+H2O+CO2? 实泡沫实火器原理
色实黑色,实管壁有液、使石灰水实实实体气体,实Na2CO3+2HCl=2NaCl+ H2O+CO2? 实加实 固逐实溶解、有使澄石灰水实实实的体清气体 NH4HCO3ΔNH3?+ H2O +CO2? 白泡沫实火器原理
色固消失体,管壁有液体,使石灰水实实实气体,MgCO3+2HCl=MgCl2+H2O+CO2? 固碳气会酸实实实期暴露空中消失 体清气体逐实溶解、有使澄石灰水实实实的 Zn+H2SO4=ZnSO4+H2? 有大量泡实气CuO +COΔ Cu + CO2 黑色逐实实实色~生、实粒逐实溶解 实实室制实实 气实生使澄石灰水实实实的 冶实金 清气体属
Fe+H2SO4=FeSO4+H2? 有大量泡实气C2H5OH+3O2点燃2CO2+3H2O 实色火生、金实粒逐实溶解 属焰、实生使石灰水实实实的、放实 酒精的燃气体Mg+H2SO4 =MgSO4+H2? 有大量泡气实
实生、金实粒逐实溶解 属Fe+CuSO4=Cu+FeSO4 实白色金表面属2Al+3H2SO4=Al2(SO4)3+3H2? 有大覆盖一实实色物实 法实实、实实 湿
量泡实生、金实粒逐实溶解 气属Cu+2AgNO3=2Ag+ Cu(NO3)2 实色金属Fe2O3+3H2 Δ 2Fe+3H2O 实色逐实实实实表面覆盖一实实白色物实 实实 白色、实管壁有液 冶实金体属,利用实的实气Al(OH)3+3HCl=AlCl3+3H2O 白色固体原性 溶解 胃舒平治实胃酸实多 Fe3O4+4H2 Δ3Fe+4H2O 黑色逐实实实实HCl+AgNO3= AgCl?+HNO3 生成白色白色、实管壁有液 冶实金体属,利用实的实气沉淀、不溶解于稀硝酸 实实Cl—的原理 原性 Ba(OH)2+ H2SO4=BaSO4?+2H2O 生2Na+Cl2Δ或点燃2NaCl 实烈燃实、色火黄成白色淀、不溶解于稀硝酸 实实沉SO42—的焰 子化合物的形成、 离原理
H2+Cl2 点燃或光照 2HCl 点燃实白色火BaCl2+ H2SO4=BaSO4?+2HCl 生成白焰、口白实 共价化合物的形成、制实实酸 瓶色淀、不溶解于稀硝酸 实实沉SO42—的原理 CuSO4+2NaOH=Cu(OH)2?+Na2SO4 实Ba(NO3)2+H2SO4=BaSO4?+2HNO3 色淀生成、上部实澄溶液 实量守恒定律沉清生成白色淀、不溶解于稀硝酸 实实沉SO42—实实 的原理
2C O+O2点燃2CO2 实色火焰 煤燃实 气MgCl2+2NaOH = Mg(OH)2?+2NaCl C + CuO 高温2Cu+ CO2? 黑色逐实实实CuCl2+2NaOH = Cu(OH)2?+2NaCl 实色、实生使澄石灰水实实实的 冶实金清气体属 溶液实色褪去、有实色淀生成 沉
Ca(OH)2+CO2= CaCO3?+ H2O 澄清CaO+ H2O = Ca(OH)2 白色实固实实状体石灰水实实实 实用CO2实实和石灰实粉刷实壁 粉末、 生石灰制实石灰实 CaCO3+H2O+CO2 = Ca(HCO3)2 白色Ca(OH)2+Na2CO3=CaCO3?+2NaOH 沉淀逐实溶解 溶洞的形成~石实的实化 有白色淀生成 工实制实、实实室制少量实沉碱
Ca(HCO3)2Δ CaCO3?+H2O+CO2? 碱
3
CuSO4H2OΔ CuSO4+5H2O ?白色粉
末实实实色 实实物实中是否含有水
尾回收气
Cl2+2NaOH=== NaCl+NaClO+H2O H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O SO2+2NaOH=== Na2SO3+H2O 通入实和NaHCO3溶液(除HCl)
通入实H2SO4(除水蒸气)
通入石灰碱(除水蒸气)
3NO2+H2O===2HNO3+NO NO+NO2+2NaOH===2NaNO2+H2O 通入硫酸实溶液(除H2S,PH3),
4
范文五:写出下列反应的化学方程式(制取气体)
写出下列反应的化学方程式:
1、实验室用过氧化氢溶液与二氧化锰混合制取氧气_______________________________________
2、实验室用氯酸钾与二氧化锰混合制取氧气_____________________________________________
3、实验室用高锰酸钾制取氧气_________________________________________________________
4、实验室用大理石与稀盐酸混合制取二氧化碳___________________________________________
5、实验室用锌与稀硫酸反应制取氢气___________________________________________________
6、实验室用锌与稀盐酸反应制取氢气___________________________________________________
写出下列反应的化学方程式:
1、实验室用过氧化氢溶液与二氧化锰混合制取氧气_______________________________________
2、实验室用氯酸钾与二氧化锰混合制取氧气_____________________________________________
3、实验室用高锰酸钾制取氧气_________________________________________________________
4、实验室用大理石与稀盐酸混合制取二氧化碳___________________________________________
5、实验室用锌与稀硫酸反应制取氢气___________________________________________________
6、实验室用锌与稀盐酸反应制取氢气___________________________________________________
写出下列反应的化学方程式:
1、实验室用过氧化氢溶液与二氧化锰混合制取氧气_______________________________________
2、实验室用氯酸钾与二氧化锰混合制取氧气_____________________________________________
3、实验室用高锰酸钾制取氧气_________________________________________________________
4、实验室用大理石与稀盐酸混合制取二氧化碳___________________________________________
5、实验室用锌与稀硫酸反应制取氢气___________________________________________________
6、实验室用锌与稀盐酸反应制取氢气___________________________________________________
写出下列反应的化学方程式:
1、实验室用过氧化氢溶液与二氧化锰混合制取氧气_______________________________________
2、实验室用氯酸钾与二氧化锰混合制取氧气_____________________________________________
3、实验室用高锰酸钾制取氧气_________________________________________________________
4、实验室用大理石与稀盐酸混合制取二氧化碳___________________________________________
5、实验室用锌与稀硫酸反应制取氢气___________________________________________________
6、实验室用锌与稀盐酸反应制取氢气___________________________________________________
写出下列反应的化学方程式:
1、实验室用过氧化氢溶液与二氧化锰混合制取氧气_______________________________________
2、实验室用氯酸钾与二氧化锰混合制取氧气_____________________________________________
3、实验室用高锰酸钾制取氧气_________________________________________________________
4、实验室用大理石与稀盐酸混合制取二氧化碳___________________________________________
5、实验室用锌与稀硫酸反应制取氢气___________________________________________________
6、实验室用锌与稀盐酸反应制取氢气___________________________________________________
转载请注明出处范文大全网 » 无机物方程式制取[精品]



 Duang你爹车祸前
Duang你爹车祸前

