范文一:乙酸乙酯皂化反应
=2080us/cm)
t/min K t /us/cm (K0-K t )/us/cm (K0?Kt) t
6 2140 480 80
7 2130 490 70
8 2100 520 65
9 2070 550 61.11111 10 2000 620 62 11 1970 650 59.09091 12 1948 672 56 13 1922 698 53.69231 14 1890 730 52.14286 15 1871 749 49.93333 16 1854 766 47.875 17 1833 787 46.29412 18 1801 819 45.5 19 1780 840 44.21053 20 1750 870 43.5 21 1731 889 42.33333 22 1720 900 40.90909 23 1697 923 40.13043 24 1674 946 39.41667 25 1652 968 38.72 26 1648 972 37.38462 27 1640 980 36.2963 28 1631 989 35.32143 29 1617 1003 34.58621
30 1609 1011 33.7
=3040us/cm)
t/min K t /us/cm (K0-K t )/us/cm (K0?Kt) t
6 2400 640 106.66667
7 2310 730 104.28571
8 2260 780 97.5
9 2180 860 95.55556 10 2090 950 95 11 2010 1030 93.63636 12 1998 1042 86.83333 13 1967 1073 82.53846 14 1954 1086 77.57143 15 1942 1098 73.2 16 1930 1110 69.375 17 1912 1128 66.35294 18 1901 1139 63.27778 19 1880 1160 61.05263 20 1871 1169 58.45 21 1862 1178 56.09524 22 1844 1196 54.36364 23 1820 1220 53.04348 24 1807 1233 51.375 25 1780 1260 50.4 26 1774 1266 48.69231 27 1761 1279 47.37037 28 1750 1290 46.07143 29 1741 1299 44.7931 30
1720 1320 44
范文二:乙酸乙酯皂化反应
乙酸乙酯皂化反应的速率常数
幻灯片2
一、目的要求
★用电导法测定乙酸乙酯皂化反应的速率常数和活化能。
★进一步了解二级反应的特点。
★掌握DDS-11D型电导率仪的使用方法。
幻灯片3
二、预习指导
1. 理解用电导法测定乙酸乙酯皂化反应速率常数和活化能的原理。
2. 了解二级反应的动力学特征。
3.了解本实验的注意事项。
幻灯片4
三、基本原理
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
t=0 a a
0 0
(1)
?0=β反a
t=t a-x a-x
x
(2)
? t=β反(a-x) + β产x
t=? 0 0
a a
? ?=β产a
(3)
(1) – (2) ? 0 – ?t = β反x –β产x =(β反 –β产)x
x = K (? 0 – ?t)
(1) – (3) ? 0 – ?? = β反a –β产a =(β反 –β产)a
a = K (? 0 – ??)
幻灯片5
三、基本原理
二级反应的速率方程:
或
求直线的斜率可得反应速率常数k。
活化能:
幻灯片6
四、仪器药品
DDS-307型电导率仪和DDS-11A型电导率仪
恒温水浴 x
停表
容量瓶(50ml)
移液管(10ml)
NaOH (分析纯)
CH3COOC2H5(分析纯)
CH3COONa(分析纯)
幻灯片7
五、实验步骤
1. 打开恒温槽电源,调节至25℃
2. 测? 0
在双管电导池中加入20mL0.0100mol?L-1 NaOH溶液,恒温10min ,测电导(电导基本不随时间变化)。
3. 测? ?
在双管电导池中加入20mL 0.0100mol?L-1 CH3COONa溶液,恒温10min ,测电导。
4. 测? t
移取10mL 0.0200mol?L-1 NaOH溶液放入A管, 10mL 0.0200mol?L-1 CH3COOC2H5放入B管,恒温10min。
幻灯片8
五、实验步骤
将B管中的CH3COOC2H5 用洗耳球吹入A管,同时按下停表,反复混合均匀,每隔2min 测一次电导,约45min 。
重复测?? ,若与前一次基本相同,即可进行下一步实验。
5. 反应活化能的测定
将反应温度调节为35℃,重复步骤2、3、4。
注意:每次测量前均需用蒸馏水冲洗玻璃容器和电极,然后用待测液淋洗3次。 幻灯片9
六、数据处理
1 将有关实验数据填入下表:
室温: 大气压: 。 ? 0 = ,
? ? = 。
幻灯片10
六、数据处理
3. 分别作25℃、35℃时 对t 图,求直线的斜率,并由此计算出 25℃和35℃时的速率常数k 。
4. 计算反应的活化能。
幻灯片11
七、附录
1、DDS-307型电导率仪
1)DDS-307型电导率仪示意图
七、附录
2)DDS-307型电导率仪的使用方法
(1)插接电源线,打开电源,并预热30min;
(2)仪器校准
将“选择”开关指向“检查”,“常数”补偿调节旋钮指向“1”刻度线,“温度”补偿调节旋钮指向“25”度线,调节“校准”调节旋钮,使仪器显示100.0μs/cm。校准完毕。
(3)测量
根据电极上所标电极常数值调节仪器面板“常数”补偿调节旋钮到相应位置。调节仪器面板上“温度”补偿调节旋钮,使其指向待测溶液实际温度。电极常数和温度补偿设置完毕,将选择“开关”置合适位置。测量过程中,显示值熄灭时,说明测量值超出量程范围,应切换“开关”至上一档量程。
幻灯片13
七、附录
2、DDS-11A型电导率仪
1)DDS-11A型电导率仪的使用方法
幻灯片14
七、附录
2)DDS-11A型电导率仪的使用方法
(1)打开电源开关,一起进入测量状态。
(2)参数设置
“电极常数”设置:按“电极常数”键仪表显示“电极常数”符号,表明进行电极常数设置,按“升”、“降”键设置所需电极常数,按“确认”键,仪器显示“测量”进入测量状态。(电极常数标在电极上端)
“温度系数”设置:按“温度系数”键仪表显示“仪表系数%”符号,表明进行溶液温度系数设置,按“升”、“降”键设置所需温度系数(一般在2.0%),然后按“确认”键,仪器显示“测量”进入测量状态。
“温度设置”:仪表“℃”符号闪烁,表明进行溶液温度设置按“升”“降”键设置到溶液温度,然后按“确认”键,仪器显示“测量”进入测量状态。
(3)仪器在测量状态下,将清洗过的电极浸入溶液中,此时显示数值即为被测溶液的电导率值。
幻灯片15
电导率与浓度的关系
范文三:乙酸乙酯皂化反应
乙酸乙酯皂化反应速率常数测定
研究人员 范嘉育 徐剑挺 胡营超 张云云
一. 摘要
了解用电导法和PH法测定化学反应速率常数,并测定微波和超声波对反应速率常数的影响,了解二级反应的特点,学会用图解法求二级反应的速率常数。经实验比较得知电导法测定的常数更加接近真值。超声波和微波均会影响反应速率常数。通过微波法和超声波法对物质进行处理,再测定反应速率常数,根据数据得知,均使反应速率常数降低。
二. 关键词
皂化反应 微波 超声波 PH法 电导法
正文
1.前言 反应速率常数是化学反应一个重要的动力学参数。根据化学反应原理, 要测定化学反应速率, 必须测出在不同反应时刻的反应物(或生成物) 的浓度, 绘制出物质浓度随时间的变化的曲线, 然后从图上求出不同反应时刻的速率。
测定反应物(或生成物) 在不同反应时刻的浓度一般可用化学方法和物理方法。化学方法是在某一时刻出取一部分物质, 并设法迅速使反应停止, 然后进行化学分析, 这样可直接得到不同时刻某物质浓度的数值, 但实验操作则往往较繁; 物理方法是在反应过程中, 对某一种与物质浓度有关的物理量进行连续监测, 获得一些原位反应的数据。
乙酸乙酯皂化反应中, 因导电离子和PH浓度均随反应时间变化而变化, 因此可用电导率仪和PH计测量皂化反应进程中电导率随时间的变化, 从而达到跟踪反应物浓度随时间变化的目的, 经过作图和数据处理, 可得到反应的反应速率常数。 2.实验部分 2.1 仪器和试剂
DDS-11AT型数字电导率仪 秒表 恒温槽 叉形电导池 移液管 0.0200mol/L NaOH 2.2 实验方法 2.2.1 电导率法
原理。在乙酸乙酯皂化反应中, 随着反应的进行, 导电能力很强的OH- 离子逐渐被导电能力弱的CH3COO - 离子所取代, 至使溶液的电导逐渐减小, 因此可用电导率仪测量皂化反应进程中的电导率, 从而达到测量反应速率常数的目的 步骤
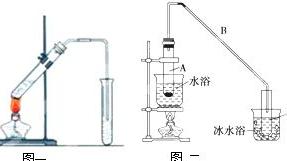
1.将恒温槽的温度调至(25. 0+ 0. 1) 0C。 2.调节电导率仪
3.溶液起始电导率k0 的测定
在干燥的叉形电导池中, 用移液管加入10mL0. 0200mo l/L的N aOH 溶液和同数量的水, 混合均匀后, 倒出少量溶液洗涤电导池和电极, 然后, 将剩余溶液倒入电导池, 恒温约 10m in, 并轻轻摇动数次, 然后将电极插入溶液, 测定溶液电导率, 直至不变为止, 此值
即为k0。
4. 反应时电导率kt 的测定
用移液管取出10mL0. 0200mo l/L的CH3COOC2H5 溶液, 加入干燥的叉形电导池中,用另一只移液管取10mL0. 0200mo l/L的N aOH 溶液加入另一干燥的叉形电导池中。将两个叉形电导池置于恒温槽恒温10m in, 并轻轻摇动数次。同时将电导池从恒温槽中取出, 弃去上次溶液,用电导水洗净。将温好的N aOH 溶液迅速倒入盛有CH3COOC2H5 溶液的叉形电导池中, 同时开动秒表, 作为反应的开始时间。迅速将溶液混合均匀, 并用少量溶液洗涤电导池和电极,然后将溶液倒入电导池, 测定溶液的电导率kt , 在2-3分钟各测电导率一次, 记下kt 和对应的时间t。 2.2.2 PH法
原理。乙酸乙酯皂化反应属二级反应,该反应的反应方程为:CH3COOC2H5 + OH- →CH3COO- + C2H5OH。反应速率方程为: v = d x/ d t = k ( a - x ) ( b - x ) ,当初始浓度相同,即a = b 时,对该式积分简化得: k =x( ta) ( a - x) ,设t 时刻溶液的pH 值为ε( t) ,则此时溶液中OH- 的浓度为Ct ( OH-) = 10(pH- 14) ,即a - x = 10(pH- 14) ,则ka = ( a - 10(pH- 14) ) / ( t ×10(pH- 14) ) 。所以用a - 10(pH- 14) 对t×10(pH- 14) 作图,可得到一条直线,该直线的斜率m = ka 即k = m/ a[5 ,6 ] 。
步骤。接通电源,调整并校准PHS - 19A 酸度计 。于干净混合反应器中,用移液管移取10 mL 0. 050 mol·L - 1NaOH 溶液于a 池中,移取10 mL 0. 050 mol·L - 1乙酸乙酯于b池中。将a ,b 池置于25 ℃的恒温槽中,等待约20 min 恒温后,将二者混合插入电极,开始记录数据。每分钟读取一次溶液的pH 值,24min 后停止实验。
结果与讨论
3.1 测定方法的确定
由2.2.1与2.2.2测皂化反应速率常数 其结果见表
由表可知 电导法测定的
K为7.0924 PH法测定的K为4.4 真值为6。38
由表可知电导法测定的K值更加准确,所以节下来的实验应采用电导法测定。 3.2微波对皂化反应速率常数的影响
为了探索微波对皂化反应速率常数的影响,本实验设定功率为中高火,时间为3分钟的微波
3.3超声波对皂化反应速率常数的影响
为了探索超声波对皂化反应速率常数的影响,本实验设定40HZ,70%和100%对样品先进行
可见,微波法和超声波法都会使反应速率常数降低。
4小结
经过实验证明电导法测得的反应速率常数比PH法测定的值更加接近真值。所以采用电导法测反应速率常数更加准确,使结果更加可信。 微波法和超声波法都会使反应速率常数降低,而且超声波法对反应的影响更大。微波的时间和功率,超声波的频率和功率均对反应速率常数有影响。
参考文献
1. 罗伟. 电导法测量乙酸乙酯皂化反应速度常数的探讨[J ] . 信阳师范学院学报, 1994 ,7(1) :62 - 64.
2. 淮阴师范专科学校化学科. 物理化学实验[M] . 北京: 高等教育出版社, 1986. 3. 北京大学化学系物理化学教研室. 物理化学实验(第3 版) [M] . 北京: 北京大学出版社, 1995.
4. 《有机化学实验》第一版 张迅主编 科学出版社
范文四:乙酸乙酯皂化反应
物 理 化 学 实 验 报 告
实 验 学 专 班 姓 指 导日
名 称: 院: 业: 级: 名:教 师: 期:
乙酸乙酯皂化反应速率常数
化学工程学院 化学工程与工艺 化工12-6班 吕博威 学 号 12402010624 王婷婷 邵丹凤 2014年5月29日
一、实验目的
1. 了解用电导法测定乙酸乙酯皂化反应的速率系数和活化能;
2. 了解二级反应的特点,学会用图解法求二级的速率系数; 3. 掌握电导率仪的使用方法。
二、实验原理
1.二级反应的动力学方程
A?B?产物
t=0 a a t=t a-x a-x
?
dcAd(a?x)dx
????k(a?x)2 (1) dtdtdt
1x
? (2) taa?x
定积分得:k? 以
x
~t作图若所得为直线,证明是二级反应,并从直线的斜率求出k。 a?x
如果知道不同温度下的速率常数k(T1)和k(T2),按阿仑尼乌斯方程计算出该反应的活化能E。
Ea?ln
k(T2)TT
?R(12) (3) k(T1)T2?T1
2.乙酸乙酯皂化反应是二级反应,反应式为:
CH3COOC2H5?NaOH?CH3COONa?C2H5OH t=0 a a 0 0 t=t a-x a-x x x t=∞ 0 0 a a
反应前后CH3COOC2H5和C2H5OH对电导率的影响不大,可忽略。故反应前只考虑NaOH的电导率?,反应后只考虑CH3COONa的电导率?。对稀溶液而言,强电解质的电导率?与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。
故存在如下关系式:
?0?A1?a ???A2?a ?t?A1(a?x)?A2x
由上三式得:x?(
?0??t1???t
)?a,代入(2)式得 k??(0)
?0???ta?t???
1?0??t
???
kat
重新排列得:?t?
因此,以?t~
?0??t
t
作图为一直线即为二级反应,并从直线的斜率求出k。由
两个不同温度下测得的速率常数k(T1)和k(T2),按阿仑尼乌斯方程计算出该反应的活化能Ea。
三、实验仪器与试剂
1.数字电导率仪(附电极)1台,恒温水槽1套,秒表1只,叉形电导管3只,直试管1只,移液管(10ml,胖肚)3根;
2.乙酸乙酯标准溶液(0.0201mol/dm3),氢氧化钠标准溶液(0.201mol/dm3)。
四、实验步骤
1.恒温槽调节
调节恒温槽温度为25℃,同时电导率仪提前打开预热。 2.?0的测定
分别取10ml蒸馏水和10ml所配NaOH标准溶液,加到洁净、干燥的叉形管中充分混匀,置于恒温槽中恒温5min。用数字电导率仪测定已恒温好的NaOH溶液的电导率?0。 3.?t的测定
在另一只叉形管的直支管中加10mlCH3COOC2H5溶液,侧支管中加10mlNaOH溶液。恒温后,混合两溶液,同时开启停表,记录反应时间,并把电导
电
极
插
入
直
支
管
中
。
当
反
应
进
行
6min,9min,12min,15min,,20min,25min,30min,35min,40min时各测电导率一次,记录电导率?t及时间t。
4.调节恒温槽温度为35℃,重复上述步骤测定其?0和?t,但在测定?t时是按反应进行4min,6min,8min,10min,,12min,15min,18min,21min,24min,27min,30min时测其电导率。
五、数据记录与处理
1.数据记录
大气压:100KPa ; 室温:31.1 ℃ 初始浓度:
cCH3COOC2H5
33
=0.0103mol/dm cNaOH=0.0103mol/dm
电极系数:0.98
-1
1、恒温温度:30℃ K0 =2381.4us.cm
?t~
?0??t
t
图
由图可知其斜率为k=10.193,则由m?
1 kc0
得k(T1)=1/(10.193×0.0103)=9.525L/(mol·min)
2、恒温温度:35℃ ko=2469.6us.cm-1
?t~
?0??t
t
图
由图可知其斜率为k=8.2254,则由m?
1 kc0
得k(T2)=1/(8.2254×0.0103)=11.803L/(mol·min)
3、已知T1=303.15K,T2=308.15K
则
Ea?ln
k(T2)TT
?R(12)=ln(11.803/9.525)*8.314*(303.15*308.15/308k(T1)T2?T1
.15-303.15) =33.308kJ/mol
六、误差分析
1、在实验仪器所产生的误差;
2、试验后计算的结果会有误差;
3、实验测定速率常数测定时,反应物与NaOH起始浓度相同,由于反应物浓度很低(0.0103mol/L),因此,很难把两种溶液的浓度配制得恰好相等,所以,实验测定时很可能反应物浓度会与预期有差距,因此,会对实验测定结果造成很大的影响。
4、乙酸乙醋易挥发,在放置过程中往往会因为发生水解,而使得浓度降低,因此,由于不能保证乙酸乙酯浓度的准确所以会影响实验结果。
范文五:乙酸乙酯皂化反应
宁 波 工 程 学 院
物理化学实验报告
专业班级 化工093 姓名 朱佳佳 实验日期 2011年5月30日 同组姓名 阮小琳 指导老师 付志强、罗利娟 序号 09402010304
一、 实验目的
1. 了解用电导法测定乙酸乙酯皂化反应的速率系数和活化能。
2. 了解二级反应的特点,学会用图解法求二级反应的速率系数。
3. 掌握电导率仪的使用方法。
二、 实验原理
1. 二级反应动力学方程
A + B → 产物
t=0 a a
t=t a-x a-x
-dcA/dt=-d(a-x)/dt=dx/dt=k(a-x) 2 (1)
定积分得: kt=x/a(a-x) (2)
以x/(a-x)对t作图,若所得为一直线,证明是二级反应,由斜率即可求出反应速率常数k值。如果知道不同温度下的速率常数k(T1)和k(T2),按阿仑尼乌斯方程计算出该反应的活化能Ea。
Ea=ln( k(T2)/ k(T1)) ×R T1 T2 / (T2- T1) (3)
2. 乙酸乙酯皂化反应是二级反应,反应式为:
CH3COOC2H5+NaOH ? CH3COONa+ C2H5OH
t=0 a a 0 0
t=t a-x a-x x x
t?∞ 0 0 a a
κ0=A1·a κ∞=A2·a κt=A1(a-x)+A2x
由上三式得:x=(κ0-κt)a/ (κ0-κ∞),代入式(2),重新排列得
κt=(κ0-κt) /kat +κ∞ (4)
因此,以κt 对(κ0-κt) /t 作图为一直线即为二级反应,由斜率即可求出反应速率常数k值;由两个不同温度下测得的速率常数k(T1)和k(T2),按式(2.9.3)计算出该反应的活化能Ea。
三、 仪器和试剂 实验名称 乙酸乙酯皂化反应速率常数的测定
仪器:数字电导率仪1台,恒温水槽1套,叉形电导管2只,移液管(10ml,胖肚)3根;
药品:乙酸乙酯标准溶液(0.0212 mol·dm-3),NaOH标准溶液(0.0212 mol·dm-3)。
四、 实验步骤
1. 调节恒温槽
调节温度为25℃,同时电导率仪提前打开预热。
2. κ0的测定
分别取10ml蒸馏水和10ml NaOH标准溶液,加到洁净干燥的叉形管中充分混匀,然后将其置于25℃恒温槽中,恒温5min,并接上电导率仪,测其电导率值κ0。
3. κt的测定
在另一支叉形管的直支管中加10ml CH3COOC2H5标准溶液,侧支管中加10ml NaOH标准溶液,放入25℃恒温5min后,将其混合均匀并立即记时,同时用该溶液冲洗电极三次,开始测量其电导率值(由于反应为吸热反应,开始时会有所降低,因此一般从第6min开始读数)当反应进行6min,9min,12min,15min,20min,25min,30min,35min,40min时各测电导率一次,记录电导率κt及时间t。
反应结束后,倾去反应液,洗净电导池及电极,将铂黑电极浸入蒸馏水中。
4. 调节恒温槽温度为35℃,重复上述步骤测定其κ0和κt ,但在测定时是按照进行4min, 6min,8min,10min,12min,15min,18min,21min,24 min,27min,30min时测其电导率。
五、 数据记录与处理
室温: 28.6 ℃ 大气压力: 100.26 kPa 初始浓度:C CH3COOC2H5dm-3 C NaOHmol·dm-3
表2.9.1 电导率随时间的变化(25℃,κ
-1)
表2.9.2 电导率随时间的变化(35℃,κ
-1)
∴由图可得25℃时直线斜率k1=12.13629,35℃时直线斜率k2=9.89922,
则k(T1)=1/( k1×C CH3COOC2H5 )=1 ÷ (12.13629×0.0106)=7.77
k(T2) = 1÷(9.89922×0.0106)=9.53
∴根据式(3)可得, Ea = ln ( k(T2)/ k(T1)) ×R T1 T2 / (T2- T1)
故Ea = ln (9.53÷7.77) ×8.314 ×298.15 ×308.15÷10=15.60kJ/mol
六、结果与讨论
1每次更换电导池中的溶液时,都要先用电导水淋洗电极和电导池,然后再用被测溶液淋洗2至3次。
2乙酸乙酯溶液和NaOH溶液浓度必须相同。
3乙酸乙酯溶液需临时配制,配制时动作要迅速,以减少挥发损失。
4乙酸乙酯皂化反应为吸热反应,混合后体系温度降低,所以在起始的几分钟内所测得的电导率偏低。



 我了个来
我了个来

