范文一:缺血再灌注损伤
八、缺血-再灌注损伤
ischemia-reperfusion injury:组织器官缺血一段时间,重新恢复血流后,组织损伤程度进一步加重的现象,甚至出现不可逆性的损伤,称为缺血-再灌注损伤
Reperfusion injury refers to damage to caused when supply returns to the tissue after a period of .
原因:缺血+血流重新恢复1.全身循环障碍后恢复血液供应2.组织器官缺血后血流恢复3.某一血管再通后发生机制
条件; 1、缺血时间的长短(过短功能恢复,过长坏死) 2、组织器官缺血前的功能状态(侧支循环,需氧程度)
3.灌注液 高压、高温、高pH、高钠、高钙液灌注 可诱发或加重再灌注损伤
钙反常、氧反常、pH反常(pH paradox)
发生机制
(一)自由基的作用
1、自由基(free radical):外层轨道上有未配对电子的原子、原子团或分子的总称。自由基性质活泼;易与其他物质反应形成新的自由基
活性氧(reactive oxygen species, ROS):化学性质较基态氧活泼的含氧物质,包括氧自由基和非氧自由基的含氧产物。
氧化应激:活性氧生成过多或机体氧化能力不足。
-自由基的生成:(1)线粒体是O·2生成的主要场所 (2)某些物质自然氧化:(3)酶催化: XO、NADPH氧化
酶、醛氧化酶(4)毒物作用于细胞
自由基的清除:(1)低分子清除剂(细胞内外水相:半胱氨酸、Vit C、谷胱甘肽 ;细胞脂质:Vit E、 Vit A ;胞浆:还原性辅酶Ⅱ)(2)酶性清除剂 超氧化物歧化酶(MnSOD CuZnSOD) 过氧化氢酶(CAT)其辅基含4个血红素 过氧化物酶(H2O2)(3)蛋白性抗氧化剂 铜篮蛋白
2、缺血-再灌注时自由基生成增多的机制
(1)黄嘌呤氧化酶途径
缺血:ATP↓,Ca离子泵功能↓,Ca离子进入细胞激活Ca离子依赖蛋白酶,促使大量的黄嘌呤脱氢酶转变为黄嘌呤转化酶;再灌注:ATP分解代谢增强,组织中次黄嘌呤大量堆积。大量氧分子进入缺血组织。黄嘌呤氧化酶催化次黄嘌呤转变为黄嘌呤进而催化黄嘌呤转变为尿酸,释放出大量电子,以氧分子(脱氢酶途径以NAD+)作为电子受体产生大量超氧阴离子和H2O2
(2)中性粒细胞激活
缺血:补体系统激活或经细胞膜分解产生多种趋化因子,吸引、激活中性粒细胞。
再灌注:氧供应迅速、大量↑,产生大量自由基——呼吸爆发或氧爆发。
(3)、线粒体
缺血:ATP↓,Ca离子进入线粒体↑,线粒体功能受损,氧分子经单电子还原形成超氧阴离子↑;Ca离子进入线粒体↑,SOD、过氧化氢酶减少和活性↓。
再灌注:氧供应迅速、大量↑,超氧阴离子↑
(4)儿茶酚氨的自身氧化
(5)体内清除自由基的能力下降(适应低氧环境,突然高氧)
3、自由基在缺血-再灌注损伤中的作用:(自由基可与脂质、蛋白质、核酸发生氧化反应,导致细胞结构损伤和功能代谢障碍 )
(1)膜脂质的过氧化,损伤生物膜双键氧化、脂质交联(①破坏膜的正常结构:脂质过氧化使膜性结构中的不饱和脂肪酸减少,膜的液态性、流动性降低,通透性增加。②间接抑制膜蛋白功能,脂质过氧化使膜脂质之间形成交联和聚合,可间接抑制膜蛋白功能,造成离子泵功能异常和受体信号传导障碍。③促进自由基和其他生物活性物质生成。膜脂质过氧化可激活磷脂酶C和磷脂酶D,降解膜磷脂,形成多种血管活性物质:PG、TXA2、白三烯等,促进再灌注损伤。④线粒体膜损伤,减少ATP生成。进一步损伤线粒体
功能,加重缺血组织的能量危机。
(2)蛋白质功能障碍巯基氧化、双键氧化
(3)破坏核酸及染色体双键氧化、DNA断裂 自由基可使碱基羟化或DNA断裂,导致染色体畸变或细胞死亡。
(4)糖类双键氧化 受体构型改变、糖蛋白变性
(二)钙超载: 各种原因引起的细胞内钙含量异常增多,并导致细胞结构损伤和功能代谢障碍的现象。
1.Na-Ca交换异常, (1)细胞内高Na+对Na+/Ca2+交换蛋白的直接激活(缺氧,ATP↓,Na+泵↓)(2)细胞内高H+对Na+/Ca2+交换蛋白的间接激活(缺血时:细胞内外均酸中毒,细胞内启动Na++交换而造成[Na+(3)蛋白激酶活化对Na+/Ca2+交换蛋白的间接激活(儿茶酚胺)
2.生物膜损伤
(1)细胞膜损伤①缺血→细胞膜外板和糖被膜表面分离→Ca2+通透性↑②[Ca2+]i↑→激活磷脂酶→↑膜磷脂降解→膜通透性↑③自由基产生↑→损伤生物膜
(2)肌浆网膜损伤 线粒体膜损伤,ATP产生↓
结果:再灌注时外Ca2+内流增加+钙泵摄取减少,致钙超载
钙超载引起再灌注损伤的机制: 促进氧自由基生成 加重酸中毒 破坏细胞(器)膜 线粒体功能障碍 激活多种酶
(三)白细胞的作用
IRI时白细胞增多的机制: 粘附分子生成增多 趋化因子生成增多
无复流现象(no-reflow):缺血组织再灌注时某些缺血区域不能得到充分的灌注。中性粒细胞激活及其致炎因子的释放是病理生理学基础。
缺血时,已有白细胞聚集,且缺血时间越长,聚集越多,再灌注时:白细胞聚集和激活进一步↑:①再灌注损伤→膜磷脂降解→趋化因子产生、释放↑②再灌注期,中性粒细胞等释放炎症介质③再灌注期,中性粒细胞和血管内皮细胞表达粘附分子↑
激活的中性粒细胞和血管内皮细胞释放致炎物质(自由基、蛋白酶、细胞因子)→局部炎症反应,微血管损伤:
第二节 重要脏器的缺血-再灌注损伤
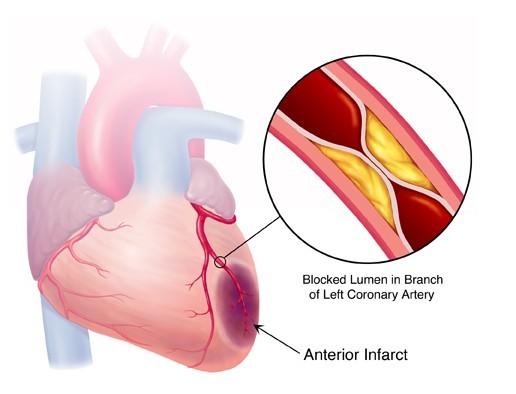
一.心脏的缺血-再灌注损伤
(一)心功能变化(标志是出现收缩带)
1.心律失常,室性心率失常为主,常见室性心动过速和心室纤颤
机制(1)缺血区/缺血边缘区/正常三种心肌之间动作电位时程的不均一性→兴奋折返(2)钙超载:再灌注时高[Na+]i→激活Na+/Ca2+交换蛋白→动作电位平台期Ca2+内流增加→平台期延长(3)其他:缺血及再灌注后胞内外电介质改变、儿茶酚胺等
2.心肌舒缩功能降低 与心肌坏死、持续性心肌缺血不同 心肌抑顿(mycardial stunning):心肌短时间缺血后不发生坏死,但引起的结构、代谢和功能改变再灌注后不立刻恢复,常需数小时、数天或数周才能恢复正常的现象,其特征为可逆性收缩功能障碍。(机制:自由基、钙超载、能量供应不足)临床常见于溶栓治疗、心绞痛缓解以及PTCA、冠脉搭桥、心脏移置后)
(二)心肌超微结构的变化 与单纯心肌缺血基本相同,出现质膜、肌原纤维、线粒体的结构破坏。收缩带:再灌注引起心肌超微结构严重损害的一个标志 机制:再灌注→细胞获得能量+钙超载→肌原纤维过度收缩→细胞骨架破坏
再灌注→移出缺血期堆积的H+→减轻或消除了H+对心肌收缩的抑制作用
2、脑的缺血-再灌注损伤(脂质过氧化)
第三节 缺血预适应
Preconditioning概念:
预先反复短暂缺血再灌注可以提高心肌组织对随后持续缺血的耐受性,其保护作用包括缩小缺血再灌注后
心肌梗死范围、减少恶性心律失常发生和促进心脏功能恢复等。
特点:1、有限记忆性(预处理经过较长时间后保护作用丧失) 2、呈双峰分布 3、普遍性 4、非特异性: 预处理方法不同,产生的保护作用却十分相似。
防治的病理生理基础
缩短缺血时间
控制再灌注条件
清除自由基:VitE、A、C GSH-PX CAT SOD
减轻钙超载
中性粒细胞抑制剂的应用
范文二:缺血再灌注损伤
缺血-再灌注损伤
机体组织器官正常代谢、功能的维持,有赖于良好的血液循环。各种原因造成
的 局部组织器官的缺血,常常使组织细胞发生缺血性损伤( ischemia injury ),但在动物试验和临床观察中也发现,在一定条件下恢复血液再灌注后,部分动物或患者细胞功能代谢障碍及结构破坏不但未减轻反而加重,因而将这种血液再灌注后缺血性损伤进一步加重的现象称为缺血再灌注损伤( ischemia-reperfusion injury )。
用低氧溶液灌注组织器官或在缺氧的条件下培养细胞一定时间后,再恢复正常氧供应,组织及细胞的损伤不仅未能恢复,反而更趋严重,这种现象称为氧反常( oxygen paradox )。用无钙溶液灌流大鼠心脏后,再用含钙溶液进行灌流时,心肌细胞的损伤反而加重,称为钙反常( calcium paradox )。缺血引起的代谢性酸中毒是细胞功能及代谢紊乱的重要原因,但在再灌注时迅速纠正缺血组织的酸中毒,反而会加重缺血再灌注损伤,称为 pH 值反常( PH paradox )。
第一节 缺血-再灌注损伤的原因及条件
一、原因
(一)、组织器官缺血后恢复血液供应如休克时微循环的疏通、冠状动脉痉挛的缓解、心脏骤停后心脑肺复苏等。
(二)、动脉搭桥术、 PTCA 、溶栓疗法等血管再通术后,心脏外科体外循环术、器官移植及断肢再植等。
二、条件
并不是所有缺血的组织器官在血流恢复后都会发生缺血 - 再灌注损伤,但许多因素可影响其发生发展和严重程度,常见的原因有:
(一)、缺血时间 缺血时间的长短与再灌注损伤的发生与否相关,缺血时间过短或过长都不易发生再灌注损伤。例如:大鼠心肌缺血 2min 以内或 20min 以上进行再灌注,不易发生再灌注损伤;狗心肌缺血 15min 以内或 40min 以上进行再灌注,再灌注损伤不易发生,缺血 15-20min 再灌注,心肌再灌注损伤的发生率高达 25%-50% 。
(二)、侧支循环 缺血后侧支循环容易形成者,因可缩短缺血时间和减轻缺血程度,不易发生再灌注损伤,如肺脏。
(三)、需氧程度 对氧需求量高的组织器官,如心、脑等,易发生再灌注损伤。
(四)、再灌注条件 一定程度的低压、低温( 25℃ )、低pH 、低钠、低钙溶液灌流,可减轻组织器官的再灌注损伤、使其功能迅速恢复。反之,高压、高温、高钠、高钙灌注可诱发或加重再灌注损伤。
第二节 缺血再灌注损伤的发生机制
一、自由基的作用
(一)、自由基的概念及分类
自由基( free radical )是指在外层电子轨道上具有单个不配对电子的原子、原子团或分子的总称,又称游离基,如氯自由基( Cl·)、羟自由基( OH·)、甲基自由基( CH3·)等。自由基的种类很多,主要包括非脂性自由基和脂性自由基,前者主要指氧自由基。
1.氧自由基 由氧诱发的自由基称为氧自由基,属于活性氧的一种,包括超氧阴离子和羟自由基。
过氧化氢本身不是自由基,是一种活性氧。 H2O2 在 Fe2+ 或 Cu2+ 的作用下可生成 OH . 或者通过 H2O2 的均裂产生 OH. ,这是 H2O2 造成细胞氧化应激的主要机制。
单线态氧也不是自由基,而是激发态的分子氧,也属于活性氧的范畴 。
2.脂性自由基 指氧自由基与多价不饱和脂肪酸作用后生成的中间代谢产物,如烷自由基( R ·),烷氧自由基( RO ·),烷过氧自由基( ROO·)等。
3.其他 如氯自由基( Cl·)、甲自由基( CH3·)和一氧化氮( NO )等。
(二)、缺血 - 再灌注时氧自由基生成增多的机制
1.黄嘌呤氧化酶形成增多 黄嘌呤氧化酶( xanthine oxidase , XO )及其前身为黄嘌呤脱氢酶( xanthine dehydrogenase, XD ),二者主要存在毛细血管内皮细胞内。正常时 XD 占 90% , XO 只占 10% 。当组织缺血缺氧时,由于 ATP 生成减少,膜泵失灵,钙离子进入细胞增多,激活钙依赖性蛋白酶,使 XD 大量转变为 XO 。同时因缺血缺氧, ATP依次分解为 ADP、 AMP、腺苷、肌苷和次黄嘌呤( hypoxanthine ),而次黄嘌呤自身不能代谢生成黄嘌呤( xanthine ),使 XO 的底物堆积。再灌注时,缺血组织重新得到氧,在缺血时大量蓄积的次黄嘌呤在XO的作用下形成黄嘌呤,继而又催化黄嘌呤转化为尿酸,这两步反应都是以分子氧作为电子受体,结果产生大量的 O2·- 和 H2O2 , O2· - 和 H2O2 在金属铁参与下,形成 OH · 。
2.中性粒细胞的呼吸爆发 中性粒细胞被激活时耗氧量显著增加,其摄入 O2 的 70%~90% 在还原型辅酶 Ⅱ 氧化酶( NADPH oxidase )和还原型辅酶 Ⅰ 氧化酶( NADH oxidase )的催化下,接受电子形成氧自由基,以杀灭病原微生物。另外组织缺血可激活补体系统,或经细胞膜分解产生多种具有趋化活性的物质, 如 C 3 片段、白三烯等,吸引、激活中性粒细胞。再灌注期间组织重新获得氧供应,激活的中性粒细胞耗氧显著增加,产生大量氧自由基,称为呼吸爆发( respiratory burst )或氧爆发( oxygen burst ),可损伤组织细胞。
3.线粒体功能受损 因缺血、缺氧使 ATP 减少,钙进入线粒体增多,使线粒体功能受损,细胞色素氧化酶系统功能失调,进入细胞的氧经 4 电子还原成水减少,而经单电子还原生成氧自由基增多。而钙离子进入线粒体可使锰 ~ 超氧化物歧化酶减少,对自由基的清除能力降低,使氧自由基生成进一步增加。
4.儿茶酚胺自身氧化增加 各种应激性刺激,包括缺血、缺氧,均可使交感肾上腺髓质系统兴奋产生大量的儿茶酚胺。儿茶酚胺一方面具有重要的代偿调节作用,另一方面在单胺氧化酶的作用下,通过自氧化可产生大量的自由基。
(三)、自由基对细胞的损伤作用
1.对膜磷脂的损伤作用 ①破坏膜的组分,使膜磷脂减少,膜胆固醇和胆固醇 / 磷酸比值增加;②由于膜组分改变使膜的流动性降低;③使与膜结合的酶的巯基氧化,导致酶活性下降;④形成新的离子通道,当细胞膜两层磷脂中的磷脂过氧化氢沿膜长轴以相互吸引的方向作用时,同一层的磷脂过氧化氢聚集,并进一步形成跨膜过氧化物,从而形成新的离子通道。⑤使膜脂质和蛋白质之间、蛋白质和蛋白质之间交联或聚合,促进膜损伤;⑥促进“脂质三联体”( lipid triad )形成。膜脂质过氧化、磷脂酶活化及过量的有利脂肪酸和溶血磷脂的“去污剂”作用(即具有破坏膜结构和功能的作用)合称 “脂质三联体” 的作用。膜脂质过氧化能促进 “ 脂质三联体 ” 的形成,因为膜脂质过氧化能使细胞内 Ca2+ 含量增加,促进磷脂酶活化。磷脂酶活化水解膜磷脂导致了溶血磷脂及游离脂肪酸的聚集,进而引起细胞膜的损伤。此外自由基还可减少 ATP 生成,导致线粒体的功能抑制,使细胞的能量代谢障碍加重。
2.对蛋白质的损伤作用 自由基可引起蛋白质的交联、聚合和肽链的断裂,也可使蛋白质与脂质结合形成聚合物,从而使蛋白质功能丧失。
3.对核酸的破坏作用 自由基可作用于 DNA ,与碱基发生加成反应,而造成对碱基的修饰,从而引起基因突变;并可从核酸戊糖中夺取氢原子而引起 DNA 链的断裂。自由基还可引起染色体的畸变和断裂。
4.对细胞外基质的破坏 自由基可使细胞外基质中的胶原纤维的胶原蛋白发生交联,使透明质酸降解,从而引起基质变得疏松,弹性下降。
二、钙超载的作用
各种原因引起的细胞内钙浓度明显增多并导致细胞结构损伤和功能代谢障碍的现象称为钙超载( calcium overload )。
(一)、细胞内钙超载的发生机制
1. Na+ /Ca2+ 交换异常 生理条件下, Na+/Ca2+ 交换蛋白转运方向是将细胞内 Ca2+ 运出细胞,与细胞膜钙泵共同维持心肌细胞静息状态的低钙浓度。 Na+ /Ca2+ 交换蛋白以 3 个 Na+ 交换 1 个 Ca2+ 的比例对细胞内外 Na+ 、 Ca2+ 进行双相转运。 Na+ /Ca2+ 交换蛋白的活性主要受跨膜 Na+ 浓度的调节,此外还受 Ca2+ 、 ATP 、 Mg2+ 、H+ 浓度的影响。已有大量的资料证实, Na+/Ca2+ 交换蛋白是缺血- 再灌注损伤和钙超载时钙离子进入细胞的主要途径。
(1) 细胞内高 Na+ 对 Na+ /Ca2+ 交换蛋白的直接激活作用:缺血使细胞内 ATP 含量减少,钠泵活性降低,造成细胞内钠含量增高。再灌注时缺血的细胞重新获得氧及营养物质供应,细胞内高 Na+ 除激活钠钾泵外,还迅速激活 Na+ /Ca2+ 交换蛋白,以加速 Na+ 向细胞外转运,同时将大量 Ca2+ 转入细胞内,造成细胞内 Ca2+ 超载。
(2) 细胞内高 H+ 对 Na+ /Ca2+ 交换蛋白的间接激活作用:质膜 Na+ /H+ 交换蛋白主要受细胞内 H+ 浓度的变化,以 1:1 的比例将细胞内的 H+ 排出胞外,而将 Na+ 摄
入细胞,这是维持细胞内 PH 稳定的重要机制。缺血缺氧期,由于细胞的无氧代谢增强使 H+ 生成增加,组织间液和细胞内液 PH 明显降低。再灌注使组织间液 H+ 浓度迅速下降,而细胞内 H+ 浓度很高,形成跨膜 H+ 浓度梯度。细胞膜两侧 H+ 浓度差可激活心肌 Na+ /H+ 交换蛋白,促进细胞内 H+ 排出,而使细胞外 Na+ 内流。如果内流的 Na+ 不能被钠泵充分排出,细胞内高 Na+ 可继发性激活 Na+ /Ca2+ 交换蛋白,促进 Ca2+ 内流,加重细胞钙超载。
(3) 蛋白激酶 C ( PKC )活化对 Na+/Ca2+ 交换蛋白的间接激活作用:生理条件下,心功能主要受 β 肾上腺素能受体调节, α1 肾上腺素能受体的调节作用较小。但缺血 - 再灌注损伤时,内源性儿茶酚胺释放增加, α 1 肾上腺素能受体的调节相对起重要作用。 α1 肾上腺素能受体激活 G 蛋白 - 磷脂酶 C ( PLC )介导的细胞信号转导通路,促进磷脂酰肌醇分解,生成三磷酸肌醇( IP3 )和甘油二脂( DG ),促进细胞内 Ca2+ 的释放; DG 经激活 PKC 促进 Na+ /H+ 交换,进而促进 Na+/Ca2+ 交换,使胞浆 Ca2+ 浓度增加。
2.生物膜损伤
(1) 细胞膜损伤:生理情况下,细胞膜外板和糖被膜( glycocalyx )由 Ca2+ 紧密联结在一起。①当 Ca2+ 反常时,可使细胞糖被膜受损;②当细胞缺血缺氧时可导致细胞膜受损、破裂;③心肌缺血缺氧时,一方面使交感 - 肾上腺髓质系统兴奋,血中儿茶酚胺含量增加。儿茶酚胺能产生氧自由基,从而损伤细胞膜;另一方面,心肌缺血部位 α 肾上腺素能受体上调, α 肾上腺素能受体兴奋可导致 Ca2+ 内流增加。
(2) 线粒体及肌浆网膜损伤: 自由基增加和膜磷脂分解增强可造成肌浆网膜损伤,钙泵功能抑制使肌浆网摄 Ca2+ 减少,胞浆 Ca2+ 浓度升高。线粒体损伤抑制氧化磷酸化过程,使 ATP 生成减少,细胞膜和肌浆网膜钙泵能量供应不足,促进钙超载的发生。
(二)、钙超载引起再灌注损伤的机制
1.线粒体功能障碍 再灌注后,胞浆中Ca2+浓度大量增加,可刺激线粒体和肌浆网的钙泵摄取钙,使胞浆中的 Ca2+ 向线粒体和肌浆网中转移 。这在再灌注早期具有一定的代偿意义,可减少胞浆中钙超载的程度。但细胞内钙增多使肌浆网及线粒体消耗大量 ATP ;同时,线粒体内的 Ca2+ 离子与含磷酸根的化合物反应形成磷酸钙,干扰线粒体氧化磷酸化,使能量代谢障碍, ATP 生成减少。二者均使细胞能量供应不足。
2.激活磷脂酶 细胞内 Ca2+ 超载可激活多种磷脂酶,促进膜磷脂的分解,使细胞膜及细胞器膜均受到损伤。此外,膜磷脂的降解产物花生四烯酸、溶血磷脂等增多,增加了膜的通透性,进一步加重膜的功能紊乱。
3.通过 Na+/Ca2+ 交换蛋白形成一过性内向离子流( transicent inward current ) 在心肌动作电位后形成迟后除极( delayed after depolarization )而引起心律失常。
4.促进自由基形成 细胞内钙超载使钙依赖性蛋白水解酶活性增高,促进黄嘌呤脱氢酶转变为黄嘌呤氧化酶,使自由基生成增多,损害组织细胞。
5.使肌原纤维挛缩、断裂,生物膜机械损伤,细胞骨架破坏 其发生机制为:①缺血 - 再灌注使缺血细胞重新获得能量供应,在胞浆存在高浓度 Ca2+ 的条件下,肌原纤维发生过度收缩。这种肌纤维过度甚至不可逆性缩短可损伤细胞骨架结构 ,引起心肌纤维断裂;②再灌注使缺血期堆积的 H+ 迅速移出,减轻或消除了 H+ 对心肌收缩的抑制作用。
三、白细胞的作用
(一)、白细胞增加的机制
1.趋化物质的作用 组织缺血使细胞膜受损,再灌注损伤可使膜磷脂降解,花生四烯酸代谢产物增多,其中有些物质,如白三烯具有很强趋化作用,吸引大量的白细胞进入组织或吸附于血管内皮。白细胞与血管内皮细胞粘附后进一步被激活,本身也释放具有趋化作用的炎症介质,如白三稀 B 4 ( LB 4 ),使微循环中白细胞进一步增多。
2.细胞粘附分子的作用 粘附分子( adhesion molecule )是指由细胞合成的、可促进细胞与细胞之间、细胞与细胞外基质之间粘附的一大类分子的总称。实验发现,在缺血组织内已有白细胞聚集,其数量可随缺血时间的延长而增加;再灌注早期(数秒 - 数分钟),血管内皮细胞内原先储存的一些蛋白质前体被激活,释放多种细胞粘附分子。
(二)、白细胞对组织损伤作用的机制
1.对血液流变学的作用 实验证实,在缺血和再灌注早期白细胞即粘附于内皮细胞上,随后有大量血小板沉积和红细胞缗钱状聚集,造成毛细血管阻塞。实验表明,红细胞解聚远较白细胞与内皮细胞粘附的分离容易,提示白细胞粘附是微血管阻塞的主要原因。通过测量缺血和再灌注心肌的血流量,发现呈进行性下降趋势,特别在心内膜层降低更明显。由于血管的阻塞,平均氧弥散的距离增加,局部氧分压可降低到零,一组毛细血管网阻塞,使所支配的细胞处于低氧环境中,造成细胞功能代谢的障碍。此外,缺血再灌注组织可见到无复流现象( no-reflow phenomenon ),是指缺血再灌注时,部分或全部缺血组织不出现血液灌流的现象。
影响无复流现象的原因很多,包括缺血时间的长短、缺血程度、梗死灶大小等。无复流现象的可能机制为:①血管障碍及中性粒细胞栓塞;②血小板、血栓堵塞微血管;③细胞肿胀挤压微血管;④血液粘滞性变化等。其中中性粒细胞引起的毛细血管栓塞可能是主要原因,因为用去中性粒细胞的血液灌流,能明显减轻无复流现象。
2.产生自由基 白细胞能产生多种自由基,如活性氧,卤氧化合物等,激发细胞膜的脂质过氧化,并损伤细胞内的重要成分。
3.颗粒成分( granule constitutes )释出 在缺血损伤区,从白细胞释放酶性颗粒成分能导致细胞组织进一步损伤。中性粒细胞可释放出 20 多种酶,其中 3 种引起组织损伤最大。一种是含丝氨酸蛋白酶的弹性硬蛋白酶( elastase ),另外两种是含金属的蛋白酶即胶原酶( collagenase )和明胶酶( gelatinase )。弹性硬蛋白酶几乎能降解细胞外液基质中的所有成分,裂解免疫蛋白、凝血因子,并攻击完整的未受损的细胞,激活的胶原酶和明胶酶也能降解各种类型的胶原,导致细胞的损伤。
4.其他作用 白细胞一旦激活,也可激活磷脂酶 A2,游离出花生四烯酸,导致瀑布效应,产生许多血管活性物质,如白三烯,血小板激活因子等,使血管收缩,通透性增加,促进白细胞对血管壁的粘附等。
四、高能磷酸化合物缺乏
一些研究表明,心肌短时间缺血后,发生的损伤是可逆的,如果此时得到血液再灌,细胞不至死亡,但心肌收缩功能却不能很快恢复。说明心肌能量代谢障碍。
通过实验进一步观察发现,再灌注时心肌的高能磷酸化合物明显缺乏。说明缺血及再灌注损伤的心肌有氧代谢障碍,高能磷酸化合物缺乏。影响了心功能的恢复。
1.再灌注时高能磷酸化合物缺乏和总腺苷酸水平减少的原因:
(1) 线粒体受损 : 因缺血缺氧,线粒体产生氧自由基增多,再灌注时组织产生自由基也增多。二者均使线粒体膜发生脂质过氧化,使线粒体结构和功能受损, 表现为利用氧能力障碍,同时合成 ATP 减少。
(2)ATP 的前身物质减少 : 包括腺苷,肌苷,次黄嘌呤等,在再灌注时被血流冲洗出去,使总腺苷酸水平下降。因此如在再灌注液中补充肌苷或谷氨酸等可促进 ATP 的合成及心功能的恢复。
五、内皮素的作用
ET 促进心脏缺血再灌注损伤的机制与心肌膜上 ET 受体上调、促进胞内钙超载、 PMN 聚集、粘附、氧自由基释放及内皮细胞自稳态失衡有关。心肌缺血再灌注时,可引起心肌细胞膜上 ET 结合点密度增加。 ET 可通过蛋白 -IP 3 途径导致胞内 Ca2+ 浓度的增高,胞内 Ca2+ 浓度增高,既可导致冠脉强烈收缩,又能激活磷脂酶,使膜磷脂降解,损伤细胞膜。 ET 具有明显地促进 PMN 聚集和粘附的作用,其机制在于 ET-1 能促进 PMN 表面粘附分子 CD11/CD18 的表达,这种作用可被抗 CD18 抗体 ISI/18 阻断 。
六、血管紧张素Ⅱ( angiotension Ⅱ)的作用
Ang Ⅱ促进交感神经末梢释放儿茶酚胺、收缩血管、刺激醛固酮分泌、促进心肌血管平滑肌增殖和肥厚等生理作用,主要由 AT 1 介导。 Ang Ⅱ与再灌注损伤关系密切。主要表现在再灌注过程中 Ang Ⅱ水平增高, AT 1 受体上调,以及应用 ACE 抑制剂或 Ang Ⅱ受体拮抗剂具有抗再灌注损伤的作用。
第三节 缺血 - 再灌注损伤时机体的功能及代谢变化
一、心肌缺血再灌注损伤的变化
(一)、心肌缺血再灌注损伤的发病机制
具体机制为①激活心肌兴奋收缩耦联过程,导致肌原纤维挛缩,不但加速能量的消耗,其挛缩力可使肌纤维膜破裂;② Ca2+ 能以磷酸钙的形式沉积于线粒体,损伤线粒体功能,使 ATP 产生障碍;③激活钙依赖性的酶,进一步损伤细胞膜;④ Ca2+ 能促进血小板粘附、聚集以及释放等反应,促进血栓的形成。
(二)、再灌注对心肌电活动的影响
心肌细胞急性缺血时的电生理改变为静息电位降低,动作电位上升的速度变慢,时值缩短,兴奋性和传导性均降低,一些快反应细胞转变为慢反应细胞。在心电图上表现为缺血心肌对应部位 ST 段抬高, R 波振幅增加。再灌注使缺血中心区 R 波振幅迅速降低, ST 段高度恢复到原水平, Q 波很快出现,从而出现再灌注性心律失常。心肌缺血后对激动的传导时间延长,自律性增强,都为心律失常创造了条件。再灌注后心脏由窦性心律转变为心室颤动,或出现室性心动过速转变为室颤,这是由规律、迅速、反复的室性异位活动的结果。动物实验发现,缺血再灌注性心律失常失常的发生率可达 50%~70% ,临床上解除冠状动脉痉挛及溶栓疗法后缺血再灌注性心律失常的发生率也高达 50%~70% 。
(三)、再灌注对心功能的影响
短期缺血后再灌注心功能可得到恢复,若阻断冠脉 1 小时后再灌注,血流动力学常常进一步恶化,早在 70 年代就发现,夹闭狗冠状动脉 15min 并不引起心肌坏死,但缺血 - 再灌注后心肌收缩功能抑制可持续 12h 。这种短期缺血早期恢复灌注时,心肌收缩功能不能迅速恢复,在较长一段时间内(数天到数周),心肌收缩功能低下,甚至处于无功能状态( nonfunction state ),称为心肌顿抑( myocardial stunning )。心肌顿抑是缺血-再灌注损伤的表现形式之一,其发病机制与自由基爆发性生成和钙超载有关。
(四)、再灌注对心肌代谢的影响
短时间的缺血再灌注,可使心肌代谢迅速改善并恢复正常,但缺血时间较长后再灌注反而使心肌代谢障碍更为严重, ATP/ADP 的比值进一步降低, ATP 和 CP 含量迅速下降,氧化磷酸化障碍,线粒体不再对 ADP 反应。这是因为再灌注时自由基和钙超载等对线粒体的损伤使心肌能量合成减少;加之再灌注血流的冲洗, ADP 、 AMP 等物质含量比缺血期降低,造成合成高能磷酸化合物的底物不足。
(五)、再灌注对心肌超微结构的影响
缺血 - 再灌注损伤时,超微结构可见细胞水肿,细胞膜损伤加重,细胞挛缩加重,某些线粒体嵴破裂消失,线粒体内 Ca2+ 大量沉积,形成致密颗粒,肌原纤维断裂,节段性溶解和收缩带形成。
再灌注也可使毛细血管内皮细胞肿胀加重,胞浆形成突起物伸向管腔,内质网扩张成大小不一的空泡,引起管腔变窄,甚至阻塞,同时血小板、白细胞聚集、聚集、阻塞在微循环中。上述变化使心肌恢复灌流后,可使心肌得不到血液供应,出现无复流现象。
二、脑缺血再灌注损伤
(一)、对代谢的影响
1.代谢障碍 缺血时细胞内 ATP 、 CP 产生严重减少,影响 Na+ 泵、 Ca2+ 泵的功能。由于钠钾泵功能降低,膜离子梯度不能维持,细胞外钾离子浓度升高,而细胞内钠水潴留。再灌注时,氧自由基产生加重了膜损伤,使细胞肿胀,同时细胞内细胞器也肿胀,影
响各种细胞器功能的发挥。由于毛细血管管外水肿压迫,管内细胞的肿胀的堵塞作用,影响了脑微循环,加重脑损伤。
2.细胞内酸中毒 缺血时糖酵解增强产生大量乳酸,造成更严重的组织损伤。
3.钙稳态破坏 钙超载能触发下列的反应:①突触前兴奋性氨基:谷氨酸及 N- 甲基 -D- 天门冬氨酸( gluthamate and N-methyl-D-aspartate )释放,引起受体依赖性通道中 N 型钙通道释放。在某些神经元上存在 N- 甲基 -D- 天门冬氨酸( NMDA )受体,在有毒的兴奋性氨基酸的作用下,受体兴奋可引起受体依赖的 Ca2+ 内流。②激活磷脂酶 A 2 ,引起膜磷脂降解,游离的花生四烯酸增多,再灌注后,花生四烯酸进一步代谢,生成前列腺素类、白三烯类和血小板激活因子,并在氧自由基的作用下,启动膜脂质过氧化,形成脂性自由基,并进一步促进钙受体通道兴奋性氨基酸的释放。③激活蛋白酶,核酸内切酶,导致神经元降解,微管解聚,细胞骨架破坏。④使突出前膜和突出后膜蛋白质过度磷酸化,使线粒体滞留钙作用降低,神经末梢去极化,谷氨酸释放增多,中性蛋白酶激活, Ca2+ 大量内流,线粒体 Ca2+ 浓度缓慢增高,最终导致神经元迟发性死亡。
4.铁依赖性脂质过氧化 在脑缺血期,内皮细胞及其他细胞内铁池破裂, Fe2+ 从铁池中释出,使 OH . 形成大大增加,引起脂质过氧化,使细胞受损。
(二)、对脑功能的影响
脑缺血 - 再灌注也可造成脑功能严重受损。脑缺血时脑细胞生物电发生改变,出现病理性慢波,缺血一定时间后再灌注,慢波持续并加重。如在夹闭双侧椎动脉和双侧颈总动脉的兔脑缺血再灌注损伤模型中发现,颞叶组织内神经递质性氨基酸代谢发生明显变化,即兴奋性氨基酸(谷氨酸和天门冬氨酸)随缺血 - 再灌注时间延长而逐渐降低,抑制性氨基酸(丙氨酸、 γ- 氨基丁酸、牛黄酸和甘氨酸)在缺血 - 再灌注早期明显升高。缺血再灌注损伤时间越长,兴奋性递质含量越低,脑组织超微结构改变越明显。
(三)、对超微结构的影响
脑缺血再灌注后,线粒体肿胀,有钙盐沉积,并可见线粒体嵴断裂、核染色质凝集、内质网高度肿胀,结构明显破坏、星型细胞肿胀, Nissl 体完整性破坏、胶质细胞、血管内皮细胞肿胀,周围间隙增大并有淡红色水肿液、白质纤维间隙疏松,血管内由微血栓、髓鞘分层变性,呈现不可逆损伤 。
三、肺缺血 - 再灌注损伤
(一)、对代谢的影响
肺缺血再灌注后, ATP 下降明显, ATP/ADP 比值降低,糖原含量下降,乳酸堆积, DNA 合成降低。
(二)、对肺功能的影响
再灌注后可造成肺动脉高压,非心源性肺水肿,肺淋巴回流增加,低氧血症,肺顺应性降低,肺分流率增加,造成急性呼吸衰竭。
(三)、超微结构改变
肺缺血再灌注后,线粒体肿胀、嵴消失,内质网扩张,Ⅱ型细胞的板层体消失。内皮细胞和基底膜肿胀,Ⅰ型上皮细胞肿胀,在出血区多数毛细血管肺泡呼吸膜严重破坏,有严重的不可逆性细胞损伤。
四、其它器官缺血 - 再灌注损伤的变化
肠缺血时液体通过毛细血管滤出而形成间质水肿。再灌注后,肠道毛细血管通透性更加升高,严重肠缺血 - 再灌注损伤的特征为肠粘膜损伤。其特征表现为广泛的上皮与绒毛分离,上皮坏死,固有层破损,出血及溃疡形成。这可导致肠道的吸收功能障碍及粘膜的通透性升高,使大分子溶质得以通过。此外,损伤的肠道还可成为多种有害生物活性物质的来源。
肾缺血 - 再灌注时,血清中肌酐含量明显增加,表示肾功能严重受损。缺血 - 再灌注时肾组织学损伤较单纯缺血时更明显,表现为线粒体高度肿胀、变形、嵴减少,排列紊乱,甚至线粒体崩解,空泡形成等,以急性肾小管坏死最为严重,可导致急性肾功能衰竭。
此外,骨骼肌缺血-再灌注可导致肌肉微血管和细胞损伤,自由基增多,脂质过氧化增强。
范文三:缺血-再灌注损伤
病理理学生基病本理过之一程
缺血-再灌损伤注
Icshmieare-erpufson inijuy
r
1
第一节
述
概(
概、原因念、条件
)2
短
期不全完缺性血长时 间重缺血
可严性逆害 损死
梗3
及
恢时复血灌液注 可对性逆伤可损得获功能上 的复
恢
血缺再灌注-损
伤
4
一、 念概
血缺基的上础恢复流后血,组 织官的器伤损而加重,反至发生甚 可逆不损伤现的象
血缺-再灌注损伤
( isc hmea-irperfesiuo nnjuryi, RII
5)
I
RI研概况究
955年 1Seewll道,结报狗冠扎后脉,突如 解除然扎恢结复流血部,分物立 即发生室动而颤死亡 。160年 J9eninngs第次一提出了肌心RI概I念1968年 Ames率先报了脑道II 19R7年2197 8 19年81 Flo年er odMr yGerebern g肾IIR 肺IR 肠IIIR
6
氧
常:用反低氧溶液注组灌织器官或缺在氧
条件培下细养胞一时定间,后再复正恢常供 氧,组应及织细胞的伤不仅损能恢未复,而反 趋更重严
反钙:常用钙无液溶灌流后用再含溶钙液流
组织灌官器,造可成胞细和器官的谢和功能障代碍 结及构破更趋加坏重
pH反常:血缺再灌后时注迅速正缺纠组织血
酸中的毒,反而加会重细损伤胞的现象
7
缺血二再灌-注损的原因伤和件条
(一)原因 — —组织器官缺血在础上的基液血灌注再 、1全身循障环后恢复血液供应
碍休微克管血挛痉缓解后,心骤脏停复苏
后2、织组官器血缺后流恢血复
断再肢,器植移植官
、血3再通管
冠脉搭后桥,经术腔内冠皮血管成形脉术,溶栓 疗
8法
二(条件)(响影因素 ) 缺血时间
耐受1、可逆期、不可期期
逆2
侧支循环3 需氧程度 4 再灌条注件
9
第二节
发
机生制
自基的由用作 ※超钙载※ 白胞的细用作
10
、自由基一的用
(一作概念与分)
类自由
(基fee
rradical)
层电外子道上轨有单含 不配个对子的原子、电原子团和 分子的称总
1
1
由自分基
类 氧自?基:由氧诱由发自的基 ?由脂 性自基:由氧自由与多价不饱和脂肪基酸
用作后成的生间中代产谢物 烷自基(由 L)·、烷基(氧O·L 烷过氧基()LOO·)
其他:Cl ? ·NO ·、
2
1
※自由基 氧超阴离子(氧O2· 羟)自由基(O·H
)
活氧
(性ROS)
非由基
自单线态
氧(1O2)过 氧化(氢2H2O
)31
(
二)由自的基代 谢O2e
-
O·
2e - 2++
H
H202
e -++H
OH
·
e -H+
H2+0※
H 20
基础
O的·是其2他自基或由性氧生活成
41
O
H的·生
成Fe2 +eF+3
Fentno 应反 ·O2
H
O22
还原
H· O +O-
※ OH·H体内是性最毒强的由自基
5
1
生情况理下,自由基的成与清除处生 于动平衡态
16
(
三缺)—血灌再时自注基生由成多 增的机 1制 黄嘌氧化酶形呤成多增2 中粒细性聚集胞及活激 3 线体粒能受功 损 4儿茶酚增胺加和化氧
1
7
黄嘌1呤化氧酶XO)(的成增形
正多常时血:管内细皮(V胞C)E黄 呤氧化嘌酶(X)O1 0 %嘌黄呤脱氢(X酶D )09% 缺、缺氧血 流↑内AT 生P
激活 成Ca2+赖性蛋依白解酶
水
C2+
aDX
X
1O
8APT→APDAMP→腺 呤嘌核苷 缺次黄呤嘌苷核 血
期a2C+赖性蛋依水白解酶
XD
XO
次黄嘌 呤嘌黄呤+ O 2 ·H2+2
O再 灌
X O注
期
2O
尿酸
+O· +2H22OO
·
H91
中2粒性胞聚集及细激活
缺:血 L等T吸→引中性细粒胞到血区 缺灌:中性粒细胞激活时再伴氧耗显量↑, 著同时生大量氧产自由基呼(吸发爆 )ADNH P(( AD+N)NADP
H NA(HD)氧酶
化N
DAP+H+++
NADH
e)
O 2HO22OH·,
O·2
2
0
线粒体3能受损功缺
血C a+2
TPA
线粒
体 C2+aMn-S
OD
细胞色素
化氧酶的功失调
再灌注 O能 2·O
212
线粒体
电单子原还增强
缺血ATP 产生↓Ca +2进线粒体
细胞色入氧素化酶的功失调能 氧自由生基 M成nSO-活D性由基能
力2
2
清除
自 儿茶酚4胺增加和化
缺血氧、缺氧交 -肾感腺上质髓系统兴奋儿 酚茶 胺单氧胺酶 化O·2
32
(三)自基引起由血-再灌注损缺的伤机制1、 膜脂质氧化增强
过自基+不饱由和肪酸脂脂性自 基+过氧化由 (物质脂氧过化应反)
24
1
膜、质脂过氧化强 增1(破)膜的正常结构坏液
态、流性动性、通透 性
2(间)接制膜抑蛋白能
离子功泵能障碍功细胞信号转 导碍
障(
)促进3自由基及其它生物性物活质生成等 激活
磷脂,催化花生四烯酸产生LT、酶TAX2
(4
)粒体损伤,线ATP生 成少减
52
2蛋白质、能抑功
自由基 肽制 链裂断 蛋质和酶白子分合、聚交联 蛋白、变质性、酶的性丧失
活
、3破坏酸核染及色体
由自基(80为OH% ) .羟化或DA断N裂染 色体变畸、 基碱
4
、引起胞内钙超载细
细膜胞通透增性、钙泵功能加碍障等细 胞内aC2+浓度常异高增
6
2
2
7二钙、超(ca载cliu moervoald
概念:各)原因种起引胞内细钙量异常含 增并导多细胞结致损构和伤功能代谢 碍的现障象 正:常 胞外[aC+2 ]是内[Ca胞+2]1 000倍
0
2
8
细
膜 结胞合钙
磷膜的 脂极头部性钙 泵
C 2+
a电压 赖依性钙 道
通
C2a +aC2B
+P
+AiDPA P
TC
a+
2受体操 纵性通钙
道
Na C+a2 交换+
Mtoi
S
细R胞内钙代示意图谢
92
(一) 钙
载超生发机的
制、1a+NC-a2+交换常
正常:异3aN 1+C2a 可进+行双转相运影响 因: 素胞【N内a+】N a
+30
向正转运
a2+C
+K
N3a
+
1)细(胞内高aN+直激活接aN+-Ca2交换+蛋白
缺血 →TP↓ANa+→泵→细胞↓Na+↑内 →激N活+-aa2+交C换蛋(逆白转向运→)a2+进C入胞细
3Na+
C a+2逆向 运转
APT K+↓
Na
+
↑Ca
2+
↑
aN
+3
(1)细胞2高内+H接间活N激a+C-2a交换+白蛋
胞内H
多
过
+Na+
N+/aH +换蛋白 交H+
缺:无血氧谢代↑→细胞外H内+ 多 再灌:胞增外H+迅速减→少胞内细外
H+度差浓显 著 激活胞aN+/+H换交蛋 白内[aN]+ ↑激 活钠泵 aN+Ca-+ 交 换 蛋2 白 a2C+内流 32
缺↑时 血+H ↑H+↑K
Na++
H
+C
2a↑
+a2C+
Na+↑ Na+
再灌注时
H↓+3
aN+
3
(3)P3K的C活间接激活化a+N-a2+C交换蛋
PKC白活化促 进 交换 儿茶酚H胺受-体
+
激
活G蛋白-PL 激活CNa-+a2C+
/N
+交a激活换P
IP
2
aN↑
+aC2+
↑3
24.生 物损膜
伤(1细胞膜损伤 缺血)、自基由的坏破、磷酶的脂活 化细膜通透性胞增高Ca +2内流 (2 肌)浆网膜损 伤钙障碍,泵对aC2 +摄减取 少()线3粒膜损体 AT伤↓P 钙泵失灵 a2C增+
加胞内游离
35
(
二钙)超载引缺血再灌注损起伤的机制1、促进氧自由
生成基
进X促 XOD
、2线粒体能功碍
胞浆障C[2a]↑ 线粒体摄+钙↑AT 消耗↑P 磷钙形酸成 ,TP生成↓A
3、激
多活钙种赖性酶依AT
P、酶脂磷、蛋白酶酶、酶核36
73
、白三胞的作用
缺血细再灌注
-诱VE导、CWB表达C细粘胞附分子 细胞白粘附聚与
趋集化因子
白胞细走游组 中聚织 集放大释量 症炎质介
3
8
血缺再-灌注 粘分子 白细附胞走
粘附游聚、集
趋因化子AF、PLT
s
组织
定位释
炎症介放
质白
细胞组织浸润机的
制3
9
性粒细胞介中的导血缺再-灌注损伤
1微血.损管伤无复流现象 解:缺血原因后除缺血区并,不 能得到充分血液灌的流现象 (1)的微管血血液变学流变改 白胞细粘附聚、集红胞细集、血小聚板粘聚集附(2)微血 管径改口:变皮内肿;缩胀血管物释质放 ()微3管血透性增通:自由高基损伤2. 织细组胞伤损激活 的WC、VEC释B放大致炎量介质细胞 损伤
4
0
41
生机制发自由基的作
用钙超载 白胞细作的 ※ 缺用血-灌注再损伤往是往种
多机制共起同用的作果结
4
2三第 机节体的功能及谢变化代一
心、缺肌-血灌注损伤的再化
变心肌顿
指抑缺心血在恢复血液灌肌注后一,时 间段出现的可内性收缩功能降逆低现的 再灌象性心注律失常缺 心肌血再灌过程注出现的中心律失 常特
:室点性心律失常为
主4
3
二、
缺血脑-再灌注损伤变的 三化、他其器官血缺-再注损灌的伤化
变4
4四第节防治 原
则1 消病除,尽早因复血恢 2流控 再灌注条件 制低压低、、低温、流P低H、低、低钙 3 改善缺血钠织的组谢代 充葡补萄糖ATP、4 清除自由 基 (1)分子清低除:剂itV、 EitV 、AVitC、GS
GHSH(原还谷型胱肽甘 H)2O
254
()酶2性除剂:S清D、OC TA ATC清能除2H2, SOO能D清O除·2( 3)他清其除剂二 甲基亚、别嘌呤醇砜丹参等
、
5 减轻钙超载Ca2
+通阻道滞
剂6
其他
6
47缺 预处理(血IPC) 反短复缺血-暂再灌注,激发自 身的适性反应应使,之对随发后的持生续 性血缺耐受力提高的
4
7
范文四:缺血再灌注损伤
缺血再灌注
近年来(随着休克治疗的进步以及动脉搭桥术、溶栓疗法、经皮腔内冠脉血管成形术、心脏外科体外循环、心肺脑复苏,断肢再植和器官移植等方法的建立和推广应用,使许多组织器官缺血后重新得到血液再灌注。多数情况下,缺血后再灌注可使组织器官功能得到恢复,损伤的结构得到修复,患者病情好转康复;但有时缺血后再灌注(不仅不能使组织、器官功能恢复,反而加重组织、器官的功能障碍和结构损伤。这种在缺血基础上恢复血流后组织损伤反而加重,甚至发生不可逆性损伤的现象称为缺血再灌注损伤(ischemi-a-reperfusion injury)。
凡是在组织器官缺血基础上的血液再灌注都可能造成缺血再灌注损伤的发生。常见的有:
1组织器官缺血后恢复血液供应如休克时微循环的疏通,冠状动脉痉挛的缓解等。
2一些新的医疗技术的应用如动脉搭桥术、溶栓疗法、经皮腔内冠脉血管成形术等。
3体外循环下心脏手术。
4心脏骤停后心、肺、脑复苏。
5其他断肢再植和器官移植等。
但并不是所有缺血的器官在血流恢复后都会发生缺血一再灌注损伤,许多因索可以影响其发生及其严重程度,常见的有:
1缺血时间首先影响再灌注损伤的是缺血时间。缺血时间短,恢复血供后可无明显的再灌注损伤(因为所有器官都能耐受一定时间的缺血。缺血时间长,恢复血供则易导致再灌注损伤。若缺血时间过长,缺血器官会发生不可逆性损伤,甚至坏死,反而不会出现再灌注损伤。例如,阻断大鼠左冠状动脉5~10min(恢复血供后心律失常的发生率很高(但短于2min或超过20min的缺血,心律失常较少发生。另外,不同动物、不同器官发生再灌注损伤所需的缺血时间不同,小动物相对较短,大动物相对较长。如家免心肌再灌注损伤所需的缺血时间一般为40min,脑一般为30min(全脑血流阻断),肝脏一般为45min(部分肝血流阻断),肾脏一般为60min,小肠大约为60min,骨骼肌甚至为4小时。
再灌注损伤与缺血时间的依赖关系,提示在缺血过程中组织发生的某些变化,是再灌注损伤发生的基础,再灌注损伤实质上是将缺血期的可逆性损伤经恢复血流后进一步加重或转化为不可逆性损伤。
2侧支循环 缺血后侧支循环容易形成者,可因缩短缺血时间和减轻缺血程度,不易发生再灌注损伤。
3需氧程度 因氧易接受电子,形成氧自由基增多(因此,对氧需求高者,窖易发生再灌注损伤(如心、脑等。
4再灌注压力愈高,造成的再灌注损伤愈严重;适当降低灌注液的温度、pH值(则能减轻再灌注损伤;减少灌注液中的Ca’、Na’含量,或适当增加K’、M矿含量(有利于减轻再灌注损伤。
缺血再灌注损伤的发生机制尚未彻底阐明。目前认为自由基的作用、细胞内钙超载
和白细胞的激活是缺血一再灌注损伤的重要发病学环节。
范文五:缺血-再灌注损伤
缺血——再灌注损伤
缺血性疾病:
? 心脏:心肌梗死、冠心病
? 脑:脑梗、脑血管痉挛、脑血管狭窄
? 四肢:血栓、骨折
? 外伤:休克、DIC
? 手术:止血带
现代的主要治疗手段:溶栓、介入(支架,冠状动脉成形术)、动脉搭桥术、休克治疗的进步。
?缺血带来的损伤:缺血带来的原发性损伤,缺血——再灌注带来的继发性损伤。 ?临床意义:
1) 器官缺血后恢复血供:休克、冠脉痉挛、心脏骤停后复苏
2) 血管再通术后、动脉搭桥后
定义:缺血——再灌注损伤:缺血器官在恢复血液灌注后缺血性损伤进一步加重的现象,称为缺血——再灌注损伤(ischemia-reperfusion injury,IRI)
一:原因和条件
氧反常(低氧-缺氧——正常氧供——损伤加重)、钙反常(无钙——含钙——损伤加重)、PH反常(酸中毒——纠正酸中毒——损伤加重)
1. 原因:组织器官缺血后恢复血液供应;新医疗技术的应用
2. 影响因素:
1) 缺血时间(时间依赖性):过短——功能恢复;过长——坏死
2) 再灌注条件:压力、温度、PH、离子浓度
3) 侧支循环:缺血后容易形成侧支循环的组织,不易发生再灌注损伤。
4) 组织器官对氧的需求:需氧高的组织器官易发生再灌注损伤。
(一) 自由基(free redicals):
参与排出毒素、传递能量、杀灭细菌和病毒、寄生虫
? 氧自由基:超氧阴离子、羟自由基【活性氧ROS:氧自由基和非自由基(H2O2、单线
态氧)的总称,即含有氧的一类化学性质非常活泼的物质的总称。】
? 脂性自由基:氧自由基和不饱和脂肪酸作用后生成的中间代谢产物,如烷氧自由基、烷
过氧自由基等。
? 其他自由基
1) 自由基的清除:98%~99%的氧通过线粒体接受电子被还原成水,并释放能量。但也有
形成超氧化物或者过氧化物的,此时机体内存在的抗氧化物如维生素C、E,以及SOD、谷胱甘肽过氧化物酶、过氧化氢酶等可以及时清除他们。
2) 氧自由基增多的机制:
? 黄嘌呤氧化酶增多机制:正常时,体内黄嘌呤氧化酶占10%,黄嘌呤脱氢酶占90%。
缺血情况下。ATP缺乏导致细胞内钙离子聚积,激活钙依赖性蛋白水解酶,促使黄嘌呤脱氢酶大量转化为黄嘌呤氧化酶,黄嘌呤氧化酶将次黄嘌呤氧化为黄嘌呤,再氧化为尿酸。这个过程中以分子氧为电子接受体,生成了大量的活性氧。
? 中性粒细胞聚集及激活:缺血——再灌注使得补体系统和内皮细胞被激活,产生白三烯
等趋化因子,吸引并激活中性粒细胞摄取大量氧气,通过呼吸大爆发的形式释放大量自由基。
? 线粒体功能受损:大量钙离子进入线粒体,导致线粒体色素氧化酶系统功能失调,代谢
为超氧化物、过氧化物的氧增多,氧自由基增加。
? 儿茶酚胺增加和氧化:缺氧——交感-肾上腺髓质系统兴奋——儿茶酚胺分泌增多——
代偿作用,但过多的儿茶酚胺在单胺氧化酶的作用下生成大量的氧自由基。
3) 氧自由基引起损伤的机制:
? 膜脂质过氧化增强:生物膜富含不饱和脂肪酸,被氧化后导致:膜的正常结构被破坏,
抑制膜功能,ATP生成减少,促使自由基的形成。
? 蛋白质变性和酶的活性降低
? 染色体畸变、核酸碱基改变或DNA断裂。
(二) 钙超载
Definition:各种原因引起细胞内钙含量异常增多,并且造成细胞结构损伤和器官功能障碍的现象。
1. 钙离开细胞的途径:Ca2+泵、Na+——Ca2+交换、Ca2+——H+交换。
2. 钙超载的机制:
? Na+——Ca2+交换异常:胞内高钠、胞内高氢离子
? 生物膜损伤:通透性增加,细胞膜通透性增加导致细胞内钙离子增加,肌浆网膜通透性
增加,导致贮存的钙离子释放增加,均导致细胞内钙超载
3. 钙超载引起损伤的机制:各种钙依赖性酶的激活(促进氧自由基的生成);线粒体功能
障碍;加重酸中毒
(三) 中性粒细胞增多:
1. 白细胞增多的机制:粘附分子和趋化因子增多。
2. 白细胞介导的损伤机制:
无复流现象:指解除缺血原因后血流重新开放,但缺血组织得不到充分血液灌流的现象。
1) 微血管损伤:白细胞粘附、微血管口径改变,缩血管物质的释放、微血管通透性增加。
2) 细胞损伤:释放大量致炎物质损伤组织细胞
二:主要器官的功能变化
1. 心肌的变化:
1) 心肌舒缩功能降低:心肌顿抑(myocardial stunning):在再灌注血流恢复一定时间
内,心肌出现的可逆性收缩功能降低的现象。
2) 再灌注性心律失常:室性心动过速和心室颤动,因为缺血心肌和正常心肌的传导性和不
应期存在差异。
3) 心肌能量代谢的变化:长期缺血的心肌对氧利用障碍,恢复血供后能量代谢反而进一步
障碍。
4) 心肌超微结构的破坏:细胞膜、线粒体损伤、肌原纤维结构被破坏。
2. 脑
1) 脑能量代谢的变化:脑组织富含磷脂3,脂质过氧化是脑损伤的主要特征。
2) 脑氨基酸代谢的变化:兴奋性氨基酸降低、抑制性氨基酸升高。
3) 脑组织学:脑水肿、脑细胞坏死
三:防治的病理生理学基础
缩短缺血时间、采用低压、低温再灌注、清除自由基、减轻钙超载、中性粒细胞抑制剂的应用。



 隔壁的小马
隔壁的小马

