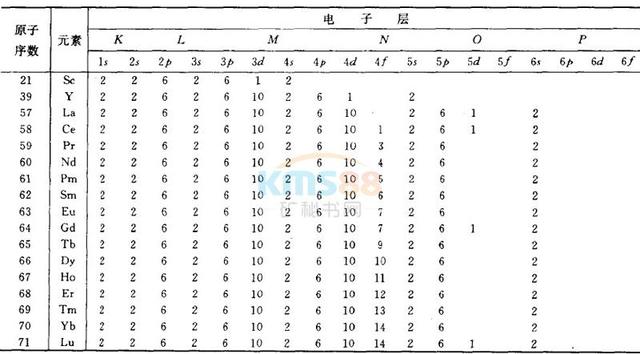
范文一:外围电子排布式
外围电子排布式:是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分(原子实)或主族、0族元素的内层电子排布省略后剩下的式子。
如Cl:1s2 2s2 2p6 3s2 3p5将'1s2 2s2 2p6'(Cl的内层电子排布,也是Ne的电子排布式)省略,'3s2 3p5'即为氯原子的外围电子排布式。同理,K原子的外围电子排布式为4s1(省略了内层电子排布1s2 2s2 2p6 3s2 3p6)、Fe原子外围电子排布式为3d6 4s2(省略了Ar的电子排布式1s2 2s2 2p6 3s2 3p6)。
在化学反应中发生变化的是外围电子,而“原子实”不受影响,外围电子排布式能更简捷地、直接地反映原子的电子层结构。
范文二:电子排布式的书写
电子排布式的书写
电子排布式的书写是新课改新增的内容,在教学大纲中对这部分内容是这样要求的:了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1-36号)原子核外电子的排布。可见,电子排布式的书写既是高中教学中的重点也是难点。
在写电子排布式之前,首先要清楚各轨道上最多容纳的电子数:ns最多容纳2个电子,np最多容纳6个电子,nd最多容纳10个电子,nf最多容纳14个电子。其次还要熟记遵循构造原理的轨道排布顺序:1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6p7p…,核外电子的排布就是按照这个顺序排的。
电子排布式的书写包括三步:1.按能量关系排出正确的轨道; 2.根据各轨道数与轨道上容纳的电子数排布,并将空轨道删去; 3.按能层的顺序进行整理得出。
例1:写出Fe原子的电子排布式。 26
解析: 第一步:1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6p7p…
2262626第二步:1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6p7p…
2262662 第三步:1s2s2p3s3p3d 4s
2262662因此,Fe原子的电子排布式为:1s2s2p3s3p3d 4s 262+ 例2:写出Fe原子的电子排布式。 262+ 解析:先按上面例1的步骤把原子的电子式排出来,Fe是在
2+Fe原子的基础上失去的2个电子。因此,Fe原子的电子排布式为:262262661s2s2p3s3p3d
电子排布式还有一种简化写法:原子实(【前一周期的稀有原 62子】)外围电子的排布式。例如:Fe的简化电子排布式为:【Ar】3d4s 26
注意洪特规则的特例:当原子核外电子在能量相等的轨道上排
000357610布时,轨道上全空(p、d、f)、半满(p、d、f)、全满(p、d、14f)结构时能量最低,所以对于像Cr、Cu的电子排布式要做适当的调整。因此有:
2262651Cr 1s2s2p3s3p3d 4s 2422626101Cu 1s2s2p3s3p3d4s 29
【习题链接】
1.写出下列原子的电子排布式:
(1)Na (2)S (3)Se (4)Ca 11163420
2.写出下列离子的电子排布式:
2+ - 2- 2+ (1)Ca(2)Cl(3)O(4)Zn2017630
范文三:亚铁离子的电子排布式
5142为什么亚铁离子的电子排布式不是[Ar] 3d4s或[Ar] 3d4s
2+2262642在学生的想法里:Fe的核外电子排布式是1S2S2P3S3P3d4S,还是应该先失
22626651 去最外层4S的电子1S2S2P3S3P3d?或者还是[Ar] 3d4s,
62理由:1、由于铁的电子排布式为[Ar]3d4s,4s为最外层,两个电子容易失去,故亚铁离子
6的核外电子排布式应该为[Ar]3d;
622、由于铁的电子排布式为[Ar]3d4s,当失去第一个4s电子后,4s轨道还有一个电子(半
5充满稳定),再失去第二个电子则是3d上的,变为3d(也是半充满),此时能量最低。因此,
51亚铁离子的核外电子排布式应该为[Ar] 3d4s
42 3、根据构造原理,先排3 d后排4 s故应先失4 s后失3 d,即[Ar] 3d4s
到底那个正确呢,
查阅了北京师范大学、华中师范大学及南京师范大学无机化学教研室联合编写、由高等教育出版社的《面向21世纪课程教材?无机化学(下册 第四版)》,书中明确提出亚铁离子的价电
6子结构为3d。该教材P736有如下一段描述:
2由表23-2可看出:?第一过渡系元素除钪外都可失去4s形成+?氧化态离子。?由于3d和4s轨道能级相近,因而可失去一个3d电子形成+?氧化态阳离子……?同一元素氧化态的变化是连续的,例如Ti的氧化态为+?、+?、+?;V的氧化态为+?、+?、+?、+?。
这是因为(n-1)d和ns轨道的能量相差不大,可以逐个失去s电子和d电子造成氧化态的连续变化
2+226266 6正确的是:Fe的核外电子排布式是[Ar]3d或1S2S2P3S3P3d
22626101由此:基态铜的核外电子排布式是1s 2s 2p 3s 3p 3d 4s
226261010一价铜离子核外电子排布应该是1s 2s 2p 3s 3p 3d或[Ar] 3d
---------------------------------------------------------------精品范文 -------------------------------------------------------------
精品范文,尽在豆丁网,放心下载,价格实惠
根据我校教师队伍的实际情况,在全面推进教师业务素质提升到基础上,本学期以培养校级骨干教师、区市骨干教师、学科带头人的不同层次师资人才为目标,立足校本培训重点做了如下工作:
1(强化管理,促进教师更新教育理念。为推进教师自我学习,学校鼓励教师网上学习,根据学校要求进行理论学习摘抄和教育博客建设。教师自学理论学习的内容要贴近学校教育和教师教学的实际,继续实行月检查考核管理制度。
2(组织落实,安排教师参与各级培训。为提高学科教师的教学水平,认真落实区教培中心组织的各级各类的学科培训,组织教师认真参与。本学期组织安排学科教师参加润州区培训中心组织的第十二至十五期“名师讲堂”语文、数学、英语培训活动近30人次;组织教师参加省“蓝天杯”语文、数学课堂教学和省小学体育教师基本功竞赛观摩5人次;组织参加区语数英及技能学科课堂教学研讨、培训近50人次。
3. 全员培训,提升所有教师业务水平。为加快课堂与学科教学整合的步伐促进教师电子备课和多媒体应用能力,会使用现有的现代化教育手段进行课堂教学:(1)教导处9月份组织开展了全校性的现代信息技术培训:电子白板的使用培训;(2)为适应教学条件变化,11月组织了全体教师的白板书写竞赛;(3)为更新理念,12月组织全体教师参加了 “专业技术人员低碳经济2012年”课程网络培训学习,在编在校教师均完成12学时课件培训任务,计完成公需科目继续教育培训24学时。
4(搭建平台,促进青年教师专业成长。为加快培养校级骨干教师、区市骨干教师、学科带头人的不同层次骨干教师队伍,学校在全员培训的基础努力搭建平台,促进青年教师的专业成长。
2 / 3
---------------------------------------------------------------精品范文 -------------------------------------------------------------
好文档上豆丁网,应有尽有。
3 / 3
范文四:价电子排布式
第9讲:元素周期表(律) 姓名
12212612513d4s 价电子排布式4s 3d nsnp nsnp ns ns
周期 族 IA 0 一 ?A 七主七副零八族(16个族) ?A ,2种,
二 三 ,8种, 短
三 ?B ?B Al ?B ? ,8种,
四 Sc Fe Ga Ge Cu Kr , 种,
五四In Sn Sb Rb Sr Xe , 种, 长 d区 ds区 六Cs Ba Tlr Pb Bi Po Rn , 种,
规律总结:1.原子序数=_____________数=_____________数=_____________数
2.周期序数=_____________数 主族序数=_________电子数=元素的最高正价数 *最高正价数+|负价数|=8
原子序数 原子半径 金属性 非金属性 电负性 第一电离能 递变规律
同周期(从左向右)
同主族(从上到下)
范文五:电子排布式
原子结构与性质
1、电子排布式:如:氧原子 电子排布式:1s2 2s2 2p4 2、电子排布图:
3、原子结构示意图:
4、核外电子排布:
5、电子式:6、结构式:H-O-H 练习1:
1、A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为________;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________;
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为______________________________________________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为____________________________________________________。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n=________;原子中能量最高的是________电子,其原子轨道呈________形。
解析:(1)由题意知,A元素基态原子核外电子排布式为1s22s22p3,所以A为氮元素。 (2)氩为18号元素,B的负一价离子电子层结构与氩相同,所以B为氯,C为钾。
(3)因为D元素正三价离子的3d能级为半充满即3d5,由此推知D元素基态原子的核外电子排布式为1s22s22p63s23p63d64s2,因此为铁元素。
(4)E元素基态原子的M层全充满,且N层没有成对电子,只有一个未成对电子,由此推出核外电子排布式为:1s22s22p63s23p63d104s1,因此为铜元素
(5)s能级只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以元素F的原子最外层电子排布式为2s22p3,由此可知F是N元素;根据核外电子排布的能量最低原理,可知氮原子的核外电子中2p能级的能量最高,p电子的原子轨道呈纺锤形。 答案:(1)N (2)Cl K
(3)Fe 1s22s22p63s23p63d64s2或[Ar]3d64s2 (4)Cu 1s22s22p63s23p63d104s1或[Ar]3d104s1
(5)2 2p 纺锤
练习2:
2、根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是________。 A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是___。 A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:
________________________________________________________________________,
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:
________________________________________________________________________,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第______个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是________________________________________________________________________。
解析:(1)由表中数据知,R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族。
(2)离子的氧化性最弱,即其对应的电离能最小。由表中数据看出U的第一电离能为420 kJ·mol-1,数值最小。
(3)Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素。
(4)相邻两个电离能数据相差较大,从一个侧面说明电子是分层排布的,且各能层能量
不同。若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在ⅠA族,则第二次电离能飞跃是在失去第10个电子时发生的。
(5)R元素第二电离能有较大飞跃,S元素第三电离能有较大飞跃,T元素第四电离能有较大飞跃,由题意知三者为同周期三种主族元素,可推知R在ⅠA族,S在ⅡA族,T在ⅢA族,故原子序数R
答案:(1)E (2)D (3)C
(4)电子分层排布,各能层能量不同 10
(5)R
分子结构与性质
1、离子键 (1)离子键的特点
①特点:离子键没有方向性和饱和性。 (2)晶格能
①概念:拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量,单位为kJ·mol-1。
②意义:晶格能用来衡量离子晶体中阴、阳离子间静电作用的大小。 ③与其他量的关系:在离子晶体中,离子半径越小,离子所带的电荷数越多,则晶格能越大。晶格能越大,阴、阳离子间的离子键就越牢固,形成的离子晶体就越稳定,而且熔点越高,硬度越大 2.共价键 ①形成的本质
当成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子密度增 加,体系的能量降低。
②特点:具有饱和性和方向性。 (3)σ键和π键的判断 ①σ键稳定,π键活泼;
②共价单键是σ键;共价双键中有一个σ键和一个π键;共价叁键中有一个σ键和两个π键。
共价键>氢键>范德华力
键与化学反应中的焓变关系:ΔH=E(反应物)-E(生成物)=反应物键能总和-生成物键能总和。ΔH>0,为吸热反应,ΔHKCl>RbCl>CsCl,其
原
因
解
释
为
________________________________________________________________________。
解析:通过读取表格中数据先判断出晶体的类型及晶体的性质,应用氢键解释HF的熔点反常的原因,利用晶格能的大小解释离子晶体熔点高低的原因。 答案:(1)原子 共价键 (2)①②③④
(3)HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可) (4)②④
(5)D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高
高考:
硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题: (1)
基
态
硅
原
子
的
核
外
电
子
排
布
式
为
_______________________________________________________。 (2)晶体硅的微观结构与金刚石相似,晶体硅中Si—Si键之间的夹角大小约为________。
(3)请在框图中补充完成SiO2晶体的结构模型示意图(部分原子已画
出),并进行必要标注。
(4)下表列有三种物质(晶体)的熔点:
简要解释熔点差异的原因: ①
SiO2
和
SiCl4
:
___________________________________________________________ ________________________________________________________________________。 ②
SiCl4
和
SiF4
:
___________________________________________________________ ________________________________________________________________________。
【解析】 (1)硅是14号元素,则基态硅原子的核外电子排布式为1s22s22p63s23p2(或[Ne]3s23p2);(2)晶体硅的微观结构与金刚石相似,故晶体硅中Si—Si键之间的夹角大小约为109°28′;
(3)根据原子半径来识别出题中已画出的原子其实是同一种原子(硅原子),因此补充完成的是氧原子;(4)由表列的熔点大小结合晶体的熔点判断知识入手。 【答案】 (1)1s22s22p63s23p2(或[Ne]3s23p2) (2)109°28′ (3)
(4)①SiO2是原子晶体,微粒间作用力为共价键;SiCl4是分子晶体,微粒间作用力为范德华力,故SiO2熔点高于SiCl4
②SiCl4和SiF4均为分子晶体,微粒间作用力为范德华力,结构相似时相对分子质量越大,范德华力越大。故SiCl4熔点高于SiF4
2:A、B、C、D四种前四周期元
素,已知A属于常见元素,其+1价阳离子各层均处于全满状态,该离子在溶液中不能稳定存在,但+2价离子能稳定存在;B的第4电离能远小于第5电离能且有三个能层,C、D基态原子均有2个未成对电子且二者能形成直线形化合物。请回答下列问题: (1) A
基
态
原
子
电
子
排
布
式
为
_______________________________________________________。 (2) B与D能形成BD2型化合物,则B晶体与BD2晶体熔点较高的是________(填化学式),BD2晶体中最小环含B、D原子数目分别为________。
(3) (4)已知A、D能形成晶胞如图所示的化合物,则该化合物的化学式为____________,此物质中,实心球代表的微粒符号为
____________。
【解析】 由+1价离子在溶液中不能稳定存在,但+2价能稳定存在知,A是铜;由B的电离能数值特点知其为ⅣA族元素,结合其能层数知其是硅;由C、D基态原子的未成对电子及两者能形成直线形化合物,知C、D是碳、氧中的一个。
由B、D能形成BD2型化合物知D是氧,故C是碳,因Si—Si键的键长大于Si—O键的键长且二者均为原子晶体,故SiO2熔点较高,SiO2晶体中最小环上分别有6个硅原子、6个氧原子。
1
由晶胞示意图知,该晶胞中含有的空心球代表的微粒有1+8×82,实心球代表的微粒有4个,二者整数比为1∶2,故化学式为Cu2O;由于实心球的数目小于空心球的,故实心球应是亚铜离子。
【答案】 (1)1s22s22p63s23p63d104s1或[Ar]3d104s1 (2)SiO2 6、6 (3) Cu2O Cu+
小结:处于晶胞顶点上(立方体顶角上)的粒子,同时为8个晶胞所共1
有,每个粒子有8属于该晶胞,处于晶胞棱上(立方体棱上)的粒子,1
同时为4个晶胞所共有,每个粒子有4(立1
方体面心)的粒子,同时为2个晶胞所共有,每个粒子有2 处于晶胞内部(立方体体心)的粒子,只为1个晶胞所共有,该粒子属于该晶
胞。然后将晶胞中处于不同位置的各微粒的个数×所占的比例,即可求出该晶胞中各微粒的个数比,从而得出晶体的化学式。
堆积模型 典型代表 空间利用
简单立方堆积
配位数 6 8 12 12
晶胞
Po
率
52%
体心立方Na、K、Fe 68% 堆积
六方最密Mg、Zn、Ti 74% 堆积
Ag、Au 74% 面心立方Cu、最密堆积



 女鬼般若
女鬼般若

