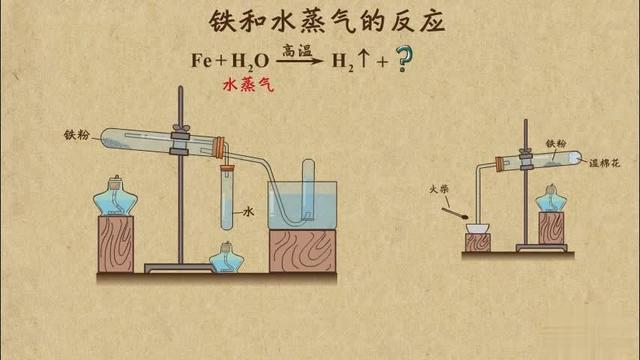
关于金属和水反应, 在新课标教材《必修1》的三章一节“金属的化学性质”里作了专讲述,除此之外,教材里再没有提起这个问题了。但是在这一节里,只是作了一个钠和水的实,附上了一张“铁粉与蒸气反应”片,教材文从未提到金属镁,连习题里几乎都未涉及到,只在这一章的总复习题的最后一个计5.1克镁铝合金中镁和含量。如果师不平时的题中扩大知识,不仔细总结和强金属和水反应规律,那么关于和水反应的问题学生就有些陌生,当然,肯定地说,绝大多高三生早已有了知识点:镁不能和冷
“Mg﹣AgCl电池是一种以海水为电解溶液的水激活电池.下列
﹣A.负极反应式为Mg﹣2e=Mg2+
﹣B.正极反应式为Ag++e=Ag
﹣C.电池放电时Cl由正极
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑”
答案D项是正确的。有的直说镁和水可以这个反应,但电池是在冷水条件下进行的,这就和镁能水反应相矛盾了,本文讨论的就是这个问。来,有一个解的条藏其中,先是由于A项中生成的Mg2+要水解,使溶液显性,故有
Mg+2H+== Mg2++H2↑合
Mg+2H2O== Mg(OH)2+ H2↑所以D 对。如果没有A项的反应,D 是不能发生的,镁比较活泼,在MgCl2、NH4Cl溶里很容生这个反应,在FeCl3溶液里更容易发生,都是由于Mg2+
这几年,盐类的解都是考点,但都是专门的考题,有一定的隐蔽性,解题时要注意考
镁与硝酸反应总式 镁与硝酸反应
导读:就爱阅读友您分享以下“镁与硝酸反应”资讯,希您有所帮
极稀的硝酸作用生成NH3,NH3 与量的硝
4Mg + 10HNO3=4Mg(NO3)2 + NH4NO3 + 3H2O
硝酸
硝酸同金属的反应比较复杂,因为(a)硝酸的浓度;(b)金的活泼性;(c)反应的温度等不同,所生成的不,并且所生成的
(1)在金属活性
1
应主要得到NO。
(2)活泼性适中的金属如:Fe、Co、Ni、Cr、Ca、Al等金属,在一般情下与HNO3不反应。这是于“钝化”作,使金属表面覆盖了一层致密的氧化膜,阻止了内层金属与硝酸应。这些金属与稀HNO3作主要生成N2O或者NO,这是由于它们的还原性较强,能将硝酸还原到较低的价态。若与更稀的硝酸反应,则可以生
(3)活泼性属如Mg、Zn等与不同浓度的稀HNO3 作用
4Zn + 10HNO3=4Zn(NO3)2 + 5H2O + N2
4Zn + 9HNO3,Zn(NO3)2 + 3H2 + NH3
3Zn + 7HNO3=3Zn(NO3)2 + ZH2O + NH2OH
(4)Au、Pt、Rh、Ti、Ta等贵金属和硝酸
(5)Sn、Pb、As、W等金属与HNO3 作用得到的是金属氧或其水合物而
2
对于同一
大。浓HNO3 ( 12-16M)被还原的
HNO3( 6-8M)被还原的主要产物
泼金同主
成NH3,NH3 与过量的硝酸反应又生
极稀的硝镁反应,不是NO3-中的N
中的H+ 被还原。镁与不同浓度硝酸反应的方程式是
Mg + 4HNO3 (浓 )=Mg(NO3)2 + 2NO2 + 2H2O
3Mg + 8HNO3(8M)=3Mg(NO3)2 + 2NO +4H2O
4Mg + 10HNO3(2M)=4Mg(NO3)2 + N2O + 5H2O
4Mg + 10HNO3(lM)=4Mg(NO3)2 + NH4NO3 + 3H2O
Mg + 2HNO3(极稀),Mg(NO3)2 +H2
百度搜
92to.com,您的在线图书馆
3
4
镁与水的反应
实验
作者:**
74 更新时间:2008-2-3
1原实验的缺陷
在必修2课本元素周期律科学究中,采用常的加热与水的方法进行科学探究,虽然可以观到中的镁条表面
2改
针对这一问题,我们对验进行了如下改进,可以达镁在水中燃的效果。 将烧杯中的水热沸后,继续加热保沸腾态。将打磨过镁条点燃之后,迅速插入沸水中(图2)。可以观察到原本沸水更剧烈滚,镁在沸水中继续燃烧,放出眼的白光。反应结束后水恢复原来沸腾的状态,滴入2滴酚酞溶液后,水由无色变为红色,烧杯底部有白色的氢氧化镁固体
3改进实验的优点
①打破常规加热的方法,创新的采用使燃烧的镁
水中燃烧,
②由此实验可出温度对化学反应的影响、对烧的进
镁铜与稀硝酸的反应
镁铜与稀硝酸的反应
悬赏分:0 - 解决时间:2010-2-19 22:41
取 xg 铜镁合金完全溶于浓硝酸中,反应过中硝酸被还原只生 8960mL 的 NO2气和 672mLN2O4的气体 (都已折标状 ) ,在反应后的溶
(A)8. 64g (B)9. 20g (C)9. 00g (D)9. 44g
求分析过程
提问者: 々军旗爱好者£ - 四 级
最佳答案
这题貌似做过 ..
其实铜和镁的酸氧化后都显 +2价 , 以完全
而增加
672mlN2O4→1344mlNO2
所以总共
所以被
写出
Cu + 4HNO3(浓 )=Cu(NO3)2 +2NO2↑+2H2O
所以与 Cu 和 Mg 结合的硝酸根为也为 0.46mol
这 0.46mol 随后完全被 OH-替代
所以 m(OH-)=0.46mol*17g/mol=7.82g
x=17.02g-7.82g=9.20g
答案 B
水垢可以看作有多种物质组成的混合物 , 为研究有的水 Ca Mg HCO3所成垢的化学 组成 , 取燥的水垢 6.32G, 加热使其失去结晶水 , 得到 5.78G 固体 A 温灼烧 A 至恒重, 残余体为 CAO 和 MGO, 放出的气体用过量的 BA[OH]2溶液吸收 , 得到沉淀 11.82. 1中是
2 5.78G剩余固体 A 灼烧至恒重的生的气完全被碱石灰吸收 , 碱石灰会增中 2.82,通过
问题补充:
不是
是三种离子
提问者: cila123 - 二 级
最佳答案
你的
水垢可以看作由多种物质组成的混合物,为研究含 Ca2+, Mg2+, HCO3-的所形成水垢 的组成, 取干燥的垢 6.32g 加热使其失去结晶水, 得到 5.78g 剩余
(1)
(2) 5.78g 剩固体 A 灼烧至恒时产生气体完全被碱石灰吸收,碱石灰增重 2.82g , 通过计算
解答是 :
1、取干燥的水垢 6.32g 加使其失去结晶水,此我们可
以下我们可采用极值法 , 若 CO2全为 CaCO3产生 , 则可得出 A 质
2、 m(CO2) =0.06mol ×44g/mol = 2.64g,但事实上碱灰增重为 2.82g, 可见这个产生 中应含有 H2O,
Mg(OH)2;[Mg(OH)2]= n(H2O)=0.18g/18g.mol =0.01mol
得出 m[Mg(OH)2]= 0.01mol ×58g/mol = 0.58g
n(CaCO3)+ n(MgCO3)=0.06
n(CaCO3)·100g/mol + n(MgCO3)·84g/mol + 0.58g = 5.78g
解得:n(MgCO3)=0.05mol, n(CaCO3)=0.01mol
以下就好解决了 ,
0.01mol ·100g/mol +0.05mol·84g/mol /6.32g*100%=82.3%
由硫酸钠和碳酸镁两种固体组成的混合,用 40ml 盐酸全部解,在标准状下收集到 0.448升 CO2,若在溶液中加入含 0.025molBa(OH)2的溶液
⑴
⑵
⑶
如题 ~要有过程哦!
提问者:
(1)因为生成 CO2为 0.448L, 所以 CO2为 0.448/22.4=0.02mol,所
(2)因为反应后 PH 为 12,所以是过量,反应时溶液中的 Mg2+离子全被沉下
(3)盐酸
与碱反应掉的 =0.025*2-0.04-0.01*0.2(最
与 CO3 2-反应掉的 =0.02*2=0.04mol
则盐酸总量为 0.04+0.008=0.048mol,
河水或者海水中的 NaCl 的质量数大于 0.3%时则不能来溉田地。 某河水 50mL , 恰 好与 10mL0.2mol/L AgNO3溶液完全反应,生成
1、计
2、通
提问者:kenmars11 - 一 级 最佳答案
⒈ 由
1 1
0.01*0.2 X
求出 X=0.002
所以 NaCl 为 0.002mol c (NaCl ) =0.002mol/0.05L=0.04mol/L
⒉ m(NaCl)=0.002*(23+35.5) =0.117g V=50mL
密度 =m/V=2.34g/cm3>1.05g/cm3
所以不可以使用。
3
[整理版]镁与硝酸反应
极稀的硝酸与镁作用生成NH3,NH3 与量的硝
硝酸与
硝酸同金属的反应比较复杂,为(a)硝酸的浓度;(b)金属活泼性;(c)反应的温度等不同,所生成的不,并且所生成的
(1)在金属活动性序表,位于“H”以后金属如Cu、Ag、Hg等与浓HNO3 反应主
(2)活泼性适中的金属如:Fe、Co、Ni、Cr、Ca、Al等金属,在一般情况与HNO3不反应。是由“钝化”作,使金属表面覆盖了一层致密的氧化膜,阻止了内层金属与浓酸反。这些金属与稀HNO3作用要生成N2O或者NO,这是由于它们的还原性较强,能将硝酸还原到较低的价态。若与更稀的硝酸反应,则可以生
(3)活泼性金如Mg、Zn等与不同浓度的稀HNO3 作用
4Zn + 10HNO3=4Zn(NO3)2 + 5H2O + N2
4Zn + 9HNO3,Zn(NO3)2 + 3H2 + NH3
3Zn + 7HNO3=3Zn(NO3)2 + ZH2O + NH2OH
(4)Au、Pt、Rh、Ti、Ta等贵金属和硝酸不
(5)Sn、Pb、As、W等金属与HNO3 作用得到的是金属氧化其水合物而
对于同一种金属来说,酸稀则硝酸本身被还原的程度越大。HNO3 ( 12-16M)被还的主要物是NO2 ;稀 HNO3( 6-8M)被还原的要产物是NO;2 M的硝酸活泼金同主要生成N2O3,极稀的硝(1M 下)与作用生成NH3,NH3 与过量的硝反应又生成铵盐NH4NO3 。极稀的硝酸与镁反应,不是NO3-中的N被还原,而是HNO3 中的H+ 被还原。镁与不同浓度硝酸反
Mg + 4HNO3 (浓 )=Mg(NO3)2 + 2NO2 + 2H2O
3Mg + 8HNO3(8M)=3Mg(NO3)2 + 2NO +4H2O
4Mg + 10HNO3(2M)=4Mg(NO3)2 + N2O + 5H2O
4Mg + 10HNO3(lM)=4Mg(NO3)2 + NH4NO3 + 3H2O
Mg + 2HNO3(极稀),Mg(NO3)2 +H2



 你的笑就像潘金莲开窗户那一刻似的
你的笑就像潘金莲开窗户那一刻似的

